
下列实验操作中错误的是
A.蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源:2016届河北省保定市高三上学期摸底考试化学试卷(解析版) 题型:填空题
(14分)对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
请回答以下问题:
(1)硫酸工厂的酸性废水中砷(As)元素(主要以弱酸H3As03形式存在)含量极高,为控制砷的排放,某工厂采用化学沉降法处理含砷废水。
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为 ,AsH3的稳定性比NH3的稳定性 (填“强’’或“弱’’)。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成难溶的三硫化二砷,该反应的离子方程式为 。
(2)今年8月1 2日晚,天津滨海新区危险品仓库发生爆炸事故,少量氰化物因爆炸冲击发生泄漏,CN一有剧毒,泄露会污染水源和空气,需要处理。
①包知HCN为一元弱酸,则NaCN溶液的pH 7(填“>”“=”或“<”)。
②处理含CN一废水的方法之一是在微生物的作用下,CN-被氧气氧化成HC03一,同时生成NH3,该反应的离子方程式为
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如右图所示(图中“HA’’表示乳酸分子,A--表示乳酸根离子)。
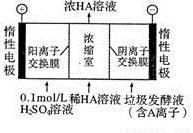
阳极的电极反应式为 简述浓缩室中得到浓乳酸的原理
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省清远市高二上学期10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
(1)增加水的量或升高温度,一定可以加快镁跟水的反应速率
(2)增大硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
(3)对于反应CaCO3(s) 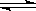 CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对于反应3H2(g) + N2(g) 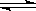 2NH3(g),在密闭容器中进行(固定体积),现充入氦气,由于容器中压强增大,则化学反应速率加快
2NH3(g),在密闭容器中进行(固定体积),现充入氦气,由于容器中压强增大,则化学反应速率加快
(5)对于反应3H2(g) + N2(g) 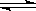 2NH3(g),使用适合催化剂,正逆反应速率同等程度加快
2NH3(g),使用适合催化剂,正逆反应速率同等程度加快
A.(1)(2) B.(1)(2)(3)
C.(1)(2)(3)(4) D.(5)
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期10月月考化学试卷(解析版) 题型:选择题
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是

A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C.c点到d点的反应中共转移0.6mol电子
D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高一上学期第一次月考化学试卷(解析版) 题型:填空题
(10分)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。(2)该气体所含原子总数为__________个。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为__ ___。
(5)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为___ __mol/L。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列有关物质分类不正确的是
A.KNO3是钾盐、硝酸盐,也是正盐
B.铝土矿、水玻璃、碱石灰都是混合物
C.有机玻璃、氮化硅都是有机高分子材料
D.BaSO4、Na3AlF6、NH4F都是强电解质
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省绥化市高三上学期期中测试化学试卷(解析版) 题型:实验题
(10分)七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣﹣硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
表2 两种盐的溶解度(单位为g/100g水)
温度/℃ | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
硼镁泥制取七水硫酸镁的工艺流程如下:
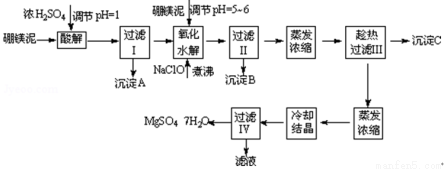
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 .加热煮沸的主要目的是 .
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 .过滤Ⅲ需趁热过滤的理由是 .
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
己知在碱性溶液中可发生如下反应:
2R(OH)3 + 3C1O- + 4OH- = 2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是
A.+3 B.+4 C.+5 D.+6
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期期中测试化学试卷(解析版) 题型:填空题
(10分)化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):
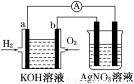
(1)对于氢氧燃料电池,下列叙述不正确的是________。
A.a电极是负极,OH-移向负极
B.b电极的电极反应为:O2+2H2O+4e-===4OH-
C.电池总反应式为:2H2+O2 2H2O
2H2O
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图右边装置中盛有AgNO3溶液,当氢氧燃料电池工作一段时间后,AgNO3溶液的pH_____________(填“增大”、“减小”或“不变”)。
(3)已知甲醇的燃烧热ΔH=-726.5 kJ/mol,在直接以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为_______________,正极的反应式为______________。
理想状态下,该燃料电池消耗1 mol甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为__________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com