
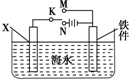
 钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.
钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.分析 (1)将一表面生锈的铁件放入盐酸中,铁锈的成分氧化铁可以和盐酸反应生成氯化铁溶液,当铁锈除尽后,金属铁会和氯化铁之间反应;
(2)①若K为碳棒,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe连接电源的负极;
②若K为锌,开关K置于a处,Zn为阳极被腐蚀,Fe为阴极被保护;
(3)图中若X为粗铜,此装置为电镀装置,即在铁件上镀铜,根据电极反应式来计算;
(4)图中若X为铜,容器中海水替换为FeCl3溶液,开关K置于M处,形成原电池,若将开关K置于N处,形成电解池,根据原电池和电解池的工作原理来回答.
解答 解:(1)将一表面生锈的铁件放入盐酸中,铁锈的成分氧化铁可以和盐酸反应生成氯化铁溶液,当铁锈除尽后,金属铁会和氯化铁之间反应:Fe+2FeCl3=3FeCl2 ,故答案为:Fe+2FeCl3=3FeCl2 ;
(2)①若X为碳棒,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe为电解池的阴极即连接电源的负极,故K连接N处,故答案为:N;
②若X为锌,开关K置于M处,Zn为阳极被腐蚀,Fe为阴极被保护,该防护法称为牺牲阳极的阴极保护法,故答案为:牺牲阳极的阴极保护法;
(3)图中若X为粗铜,此装置为电解精炼铜装置,阴极反应:Cu2++2e-=Cu,但是阳极上依次是锌、铁、镍、铜失电子的过程,铁件质量增加3.2g,结合电子守恒,X电极溶解的铜的质量小于3.2g,故答案为:<;
(4)图中若X为铜,容器中海水替换为FeCl3溶液,开关K置于M处,形成原电池,铜电极是极,发生的反应是2Fe3++2e-=2Fe2+,若将开关K置于N处,形成电解池,发生的总反应是Cu+2Fe2+$\frac{\underline{\;通电\;}}{\;}$2Fe3++Cu2+,故答案为:2Fe3++2e-=2Fe2+;Cu+2Fe2+$\frac{\underline{\;通电\;}}{\;}$2Fe3++Cu2+.
点评 本题考查学生原电池和电解池的工作原理的应用知识,属于综合知识的考查,难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体是很稳定的分散系,比溶液还稳定 | |
| B. | 胶体能发生丁达尔现象 | |
| C. | 胶体的分散质不能透过滤纸 | |
| D. | 胶体不稳定,静止后容易产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一弱电解质溶液,温度不同时,导电能力相同 | |
| B. | 强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强 | |
| C. | 强电解质在水溶液中的电离过程是不可逆的 | |
| D. | 易溶于水的电解质一定是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
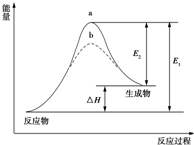
| A. | 该反应的反应热△H=E2-E1 | B. | 该反应为放热反应 | ||
| C. | 催化剂能改变反应的活化能 | D. | 催化剂能改变反应的焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前我国流通的硬币是由合金材料制成的 | |
| B. | Al与S直接化合可以得到Al2S3,则Fe与S直接化合也可以得到Fe2S3 | |
| C. | 黄铜耐腐蚀性强,不能与稀盐酸反应 | |
| D. | 某金(Au)合金的组成可表示为CuAu3.,其中金为-3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Cl>Br | B. | 金属性:Al>Mg | ||
| C. | 热稳定性:H2O>H2S | D. | 酸性:H3PO4>H3AsO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ | |
| D. | 金属钠跟水反应:2Na+2H2O=2Na++2OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com