
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |
| 编号 | 终点时消耗KMnO4溶液体积(mL) |
| 1 | 19.98 |
| 2 | 22.00 |
| 3 | 20.02 |
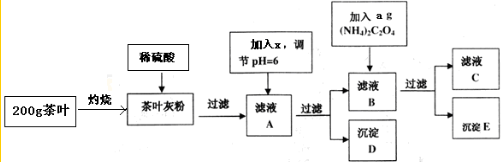
分析 茶叶中含钙、铁等微量金属元素,灼烧后加稀硫酸钙、铁等微量金属溶解成Ca2+,Fe2+等,则滤液A中Ca2+,Fe2+等,接着调节pH得发生的反应为Fe2++2NH3•H2O=Fe(OH)2↓+2NH4+,故得到的沉淀D是氢氧化铁,还有未反应的Ca2+,则滤液B中含Ca2+,加草酸铵方式的反应为Ca2++C2O42-=CaC2O4↓,故得到的沉淀E是草酸钙,还有未反应的C2O42-,则滤液C中含C2O42-,据此进行分析,
(1)②高温灼烧物质通常在坩埚内进行,据此选择;
(2)据流程图分析,第二步操作溶解灼烧后的茶叶用稀硫酸,第三步加x调节pH为6,故x为碱,还要不引入新的杂质,综合考虑;
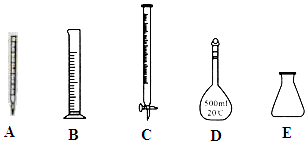
(3)①根据配制一定物质的量浓度的溶液方法及滴定操作方法选择使用的仪器;
②根据滴定结束前溶液为为无色,滴定结束时高锰酸钾溶液溶液过量进行解答;
③D为氢氧化铁,E为草酸钙,据此进行分析;
④根据滴定消耗高锰酸钾的物质的量计算出与钙离子反应剩余的草酸根离子的物质的量,再根据醋酸铵的总的质量及样品质量计算出钙离子的质量分数,注意滴定体积与样品体积的关系;
(4)根据检验铁离子遇到硫氰根离子溶液显示红色进行解答.
解答 解:(1)②高温灼烧物质通常在坩埚内进行,要用到酒精灯、坩埚、泥三角、三脚架等,
故答案为:BC;
(2)据流程图分析,第二步操作溶解灼烧后的茶叶用稀硫酸,第三步加x调节pH为6,故x为碱,还要不引入新的杂质,后面步骤中友加入了(NH4)2C2O4,故x为NH3•H2O,
故答案为:C;
(3)①将滤液C稀释至500mL时需要使用到容量瓶,滴定操作中需要使用滴定管和锥形瓶,即CDE正确,
故答案为:CDE;
②滴定结束之前溶液为无色,滴定结束时高锰酸钾溶液过量,溶液变为紫色,所以滴定终点颜色变化为滴入最后一滴KMnO4,溶液由无色变为紫色,且半分钟不恢复原色,
故答案为:滴入最后一滴KMnO4,溶液由无色变为紫色,且半分钟不恢复原色;
③D为氢氧化铁,不洗涤沉淀洗涤沉淀,将导致质量增大,故草酸钙质量减小,钙含量偏低;E为草酸钙,不洗涤沉淀洗涤沉淀,将导致质量增大,故草酸钙质量偏高,
故答案为:偏低;偏高;
④ag草酸铵的物质的量为:$\frac{ag}{124g/mol}$=$\frac{a}{124}$mol,根据反应5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O可知与钙离子反应的草酸根离子的物质的量为:$\frac{a}{124}$mol-$\frac{5}{2}$×(0.10mol•L-1×0.02L)×$\frac{250mL}{25mL}$=($\frac{a}{124}$-0.05)mol,根据化学式CaC2O4可知钙离子的物质的量为($\frac{a}{124}$-0.05)mol,所以样品中钙离子的质量分数为:$\frac{40g/mol×(\frac{a}{124}-0.05)mol}{200g}$×100%=$\frac{\frac{a}{124}-0.05}{5}$,
故答案为:$\frac{\frac{a}{124}-0.05}{5}$;
(4)滤液A中含有铁离子,可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,方法为:取少量的滤液A,滴入硫氰化钾溶液,溶液变成红色,证明溶液中存在铁离子,也证明离子茶叶中含有铁元素,
故答案为:取少量的滤液A,滴入硫氰化钾溶液,溶液变成红色,证明溶液中存在铁离子,也证明离子茶叶中含有铁元素.
点评 本题考查了探究茶叶中铁元素、钙元素的含量的方法及性质实验方案的设计,题目难度较大,注意掌握性质实验方案的设计方法,明确探究物质组成及含量的方法,试题培养了学生灵活应用所学知识解决实际问题的能力.


科目:高中化学 来源: 题型:实验题
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol•L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 3 | t2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向该溶液中加入pH=3的盐酸溶液,溶液的pH值减小 | |
| B. | 向该溶液中加入蒸馏水,CH3COOH和水的电离程度均增加 | |
| C. | CH3COOH(aq)?CH3COO-(aq)+H+(aq),Ka=1.0×10-5 | |
| D. | 0.1mol/L的CH3COONa溶液,溶液的pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 仪器 | C | D |
| 实验前 | 101.0g | 56.0g |
| 试验后 | 106.4g | 69.2g |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液中含有的氮原子数小于0.1NA | |
| C. | 用铅蓄电池电解氯化钠溶液,得到标准状况下22.4L氢气时,理论上铅蓄电池中消耗氢离子数目为4NA | |
| D. | 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素符号 | A | B | C | D | E |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com