
| 分类标准 | 能导电的物质 | 电解质 | 能电离出H+的物质 |
| 属于该类的物质 | a、g、h | b、c、e、f、h | b、c、g |
分析 (1)电解质在熔融状态下或水溶液中能导电,金属单质和半导体材料能导电;电解质是在熔融状态或水溶液中能导电的化合物,包括大多数酸、碱盐;酸电离产生的阳离子全部是H+,NaHSO4的水溶液也能电离出氢离子;
(2)氢氧化钡溶液与稀硫酸混合,反应生成硫酸钡和水,硫酸钡为沉淀物,所以离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O.????
解答 解:(1)电解质在熔融状态下或水溶液中能导电,金属单质和半导体材料能导电,能导电的物质有a、g、h,电解质是在熔融状态或水溶液中能导电的化合物,包括大多数酸、碱盐,b、c、e、f、h属于电解质,能电离出H+的物质有b、c、g,故答案为:a、g、h;b、c、e、f、h;b、c、g;
(2)氢氧化钡溶液与稀硫酸混合,反应生成硫酸钡和水,硫酸钡为沉淀物,所以离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故答案为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O.????
点评 本题考查了学生电离方程式、离子方程式的书写,为高考常见题型,侧重学生思维严密性的考查,注意离子团不能拆开这一细节以及在离子方程式中能拆的物质有强酸、强碱和可溶性盐,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol/L | B. | 1.5mol/L | C. | 3mol/L | D. | 7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
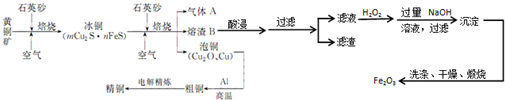
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
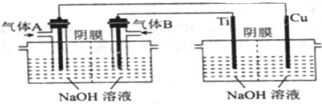 (1)工业上可利用CO2和H2生产甲醇,方程式如下:
(1)工业上可利用CO2和H2生产甲醇,方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
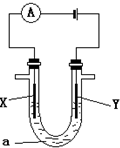
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
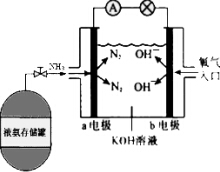 氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,回答下列问题.
氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com