
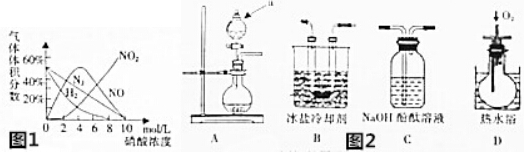
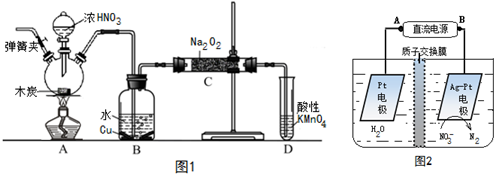
分析 (1)①根据装置图可知仪器a的名称为分液漏斗;
②图象分析可知,4mol/L硝酸和镁发生氧化还原反应生成的气体中主要是NO、NO2,其中NO体积分数最大;
③图象分析可知,装置A中镁与4mol•L-1硝酸反应生成硝酸镁、二氧化氮、一氧化氮和水,NO2沸点为21℃,通过装置B中冰盐冷却剂,二氧化氮冷却,通入装置D,通入氧气装置D中生成红棕色气体二氧化氮,最后剩余的二氧化氮气体通过氢氧化钠溶液吸收防止污染空气;
(2)①一氧化氮为无色气体,遇到空气中的氧气能被氧化成红棕色的二氧化氮;
②在D装置中一氧化氮被氧化成二氧化氮二氧化氮被氢氧化钠吸收,氢气和氮气不能被吸收;
(3)前一个C装置是吸收未被冷却的二氧化氮,在D装置中一氧化氮被氧化成二氧化氮,二氧化氮被装置C中氢氧化钠溶液吸收;
(4)硝酸被还成氮的氧化物都为气体,如果不是气体根据化合升降规则可知,应为铵盐,可以用氢氧化钠溶液及红色石饭蕊试纸检验.
解答 解:(1)①根据装置图可知仪器a的名称为分液漏斗,
故答案为:分液漏斗;
②图象分析可知在硝酸浓度4mol/L,该实验反应初始时,装置A中生成的气体中最多的是NO,
故答案为:NO;
③图象分析可知,装置A中镁与4mol•L-1硝酸反应生成硝酸镁、二氧化氮、一氧化氮和水,NO2沸点为21℃,通过装置B中冰盐冷却剂,二氧化氮冷却,通入装置D,通入氧气装置D中生成红棕色气体二氧化氮,最后剩余的二氧化氮气体通过氢氧化钠溶液吸收防止污染空气,装置的连接顺序为ABCDC,
故答案为:BCDC;
(2)①一氧化氮为无色气体,遇到空气中的氧气能被氧化成红棕色的二氧化氮,所以看到C中酚酞溶液不褪色,D装置中有红棕色气体出现,则证明体产物中有NO生成,
故答案为:C中酚酞溶液不褪色,D装置中有红棕色气体出现;
②在D装置中一氧化氮被氧化成二氧化氮,二氧化氮被氢氧化钠吸收,氢气和氮气不能被吸收,所以从后一个C装置中逸出的气体主要是氮气和氢气,
故答案为:氮气和氢气;
(3)前一个C装置是吸收未被冷却的二氧化氮,防止其对后面一氧化氮的检验产生影响,在D装置中一氧化氮被氧化成二氧化氮,二氧化氮被装置C中氢氧化钠溶液吸收,防止污染空气;
故答案为:吸收未被冷却的二氧化氮;吸收剩余二氧化氮气体,防止污染空气;
(4)硝酸被还成氮的氧化物都为气体,如果不是气体根据化合升降规则可知,应为铵盐,生成的为硝酸铵,可以在所得溶液中加入浓氢氧化钠溶液并微热,用湿润的红色石蕊试纸检验,如果红色石蕊试纸变蓝,则可证明的铵根离子产生,产物中含有硝酸铵,
故答案为:硝酸铵;取少量A中溶液于试管中,加入过量浓氢氧化钠溶液,用湿润的粉红色石蕊试纸放在试管口,微热试管如果红色石蕊试纸变蓝,则可证明铵根离子产生,产物中含硝酸铵.
点评 本题考查反应产物的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | CH3OH | B. | CH3COOCH3 | C. | C(CH3)4 | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 |  |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,用电子式表示FM2的形成过程
,用电子式表示FM2的形成过程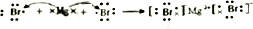 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com