
【题目】下列所示物质的制备方法合理的是
A. 实验室从海帶中提取单质碘取样→灼烧→溶解→过滤→萃取→蒸馏
B. 金红石(主要成分TiO2)为原料生产金属Ti:金红石、焦炭![]() TiCl4
TiCl4![]() Ti
Ti
C. 从卤水中(溶质主要是MgCl2)提取Mg
卤水![]() Mg(OH)2
Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl(s)
MgCl(s) ![]() Mg
Mg
D. 由食盐制取漂粉精NaCl(ag) ![]() Cl2
Cl2![]() 漂粉精
漂粉精
【答案】B
【解析】
A.海带中的碘元素以I-形式存在,从海带中提取单质碘时,过滤后要加入氧化剂将碘离子氧化为碘单质,再加入萃取剂进行萃取、分液,最后经蒸馏获得单质碘,故A错误;
B.二氧化钛和焦炭、氯气反应,产物是四氯化钛和一氧化碳;镁与TiCl4置换反应得到钛和氯化镁,稀有气体化学性质稳定,不会参与化学反应,常做保护气,故B正确;
C.直接加热蒸干水分得不到氯化镁固体,会促进氯化镁水解,最后得到氢氧化镁;应该蒸发浓缩、冷却结晶得MgCl2·6H2O晶体,然后在HCl气体环境中加热MgCl2·6H2O可得MgCl2固体,故C错误;
D.澄清石灰水浓度较低,用其制备次氯酸钙效率较低,应用石灰乳,故D错误;
答案:B


科目:高中化学 来源: 题型:
【题目】用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol·L-1FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):

(1)用KSCN溶液检验出Fe3+的现象是_______________________________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应: _____________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:

①NaCl溶液的浓度是________ mol·L-1。
②Ⅳ中检测Cl2的实验方法:______________________________________________。
③与Ⅱ对比,得出的结论(写出两点):_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:浅绿色的FeSO4·7H2O加热失水为FeSO4·H2O时呈白色,成FeSO4时为无色固体。FeSO4经加热可分解为FeO和SO3,经强热可分解为Fe2O3、SO3和SO2。SO3的熔点为16.8℃,沸点为44.8℃。化学兴趣小组对上述资料进行实验探究。
第一步:用绿矾制无水硫酸亚铁。
(1)把药品装在仪器(写名称)____中进行加热,已将结晶水除净的依据是(选填序号)___。
A.观察无水蒸汽产生 B.经恒重操作最后两次称量所得到的质量完全相同
C.晶体完全变为无色 D.经恒重操作最后两次质量差不超过天平感量误差
第二步:取一定量无水硫酸亚铁置于如图(部分夹持仪器略去)所示A的试管中进行加热。
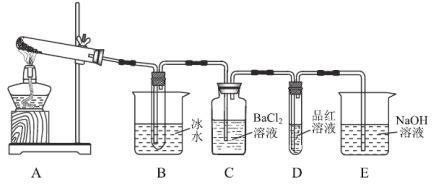
(2)实验过程中C、D、E中除有少许气泡外无其它明显现象。若将B试管中产生的少量固体溶于水,检验该溶液中的阴离子的方法是:___。实验过程中还有一处明显的现象是:________________。
第三步:将第二步实验的装置中A、B部分改为如图所示的![]() 、
、![]() ,C,D,E不变(C,E中都装有足量溶液)。
,C,D,E不变(C,E中都装有足量溶液)。
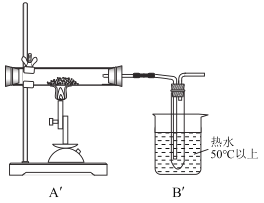
同样取一定量无水硫酸亚铁置于![]() 的石英玻璃管中进行加热,反应完毕后,从石英玻璃仪器中滞留气体排尽。观察到C中产生白色沉淀,D试管中溶液褪色。
的石英玻璃管中进行加热,反应完毕后,从石英玻璃仪器中滞留气体排尽。观察到C中产生白色沉淀,D试管中溶液褪色。
(3)实验中![]() 的玻璃管中的现象是:______,说出
的玻璃管中的现象是:______,说出![]() 装置的一个作用是:________。
装置的一个作用是:________。
最后将C中液体完全取出进行过滤、洗涤、干燥。称得所得固体质量为23.300g,所得溶液加水稀释定容为1L,取出20.00mL置于锥形瓶中,用已知浓度的标准NaOH溶液测定该1L溶液中一种溶质的浓度。
(4)上述实验过程中用到的定量仪器有_______,用到的指示剂是_______。
(5)将所得溶液加水定容时,加水所用的仪器名称为_____,若去称量![]() 玻璃管中残留固体的质量应接近于____g。
玻璃管中残留固体的质量应接近于____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的下列溶液,NH4+浓度最大的是( )
A. NH4Cl B. NH4HSO4 C. CH3COO NH4 D. NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物有许多用途,回答下列问题:
(1)基态Si原子价层电子的排布图(轨道表达式)为_________,含有长硅链的化合物不是氢化物,而是氯化物。主要原因是F比H多了一种形状的原子轨道,该原子轨道的形状为___________。
(2)SiF4分子的立体构型为_______形,SiCl4的熔、沸点均高于SiF4,主要原因是________________。
(3)SiF4可KF反应得K2SiF6晶体,该晶体可用于制取高纯硅,K2SiF6晶体中微观粒子之间的作用力有______。
a.离子键 b.共价键 c.配位键 d.分子间作用力 e.氢键

(4)H4SiO4的结构简式如图(1),中心原子Si的轨道杂化类型为_________,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是___________。
(5)硅的晶胞结构如图(2)所示,若该立方晶胞的边长为a nm,阿伏伽德罗常数的数值为NA,则距离最近的两个硅原子间的距离为_____nm,晶体硅密度的计算表达式为_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁在印刷、医药、颜料、污水处理以及有机合成催化剂方面有重要的应用。工业上常以废铁屑(含有SiO2、Al2O3、MgO、Fe2O3等杂质)为原料制备氯化铁。其生产流程如图:

已知:氢氧化物的Ksp下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
Ksp | 1.0×10-36 | 1.6×10-14 | 2.0×10-33 | 1.2×10-11 |
请回答下列问题:
(1)物质X最好选用下列物质中的____(选填序号),加入X的目的是_________。
A.KMnO4 B.FeCl3 C.H2O2 D.HNO3
(2)滤液Ⅰ加入NaOH溶液的目的是调节溶液的pH。已知滤液Ⅰ中c(Fe3+)为1.0mol·L-1,c(Al3+)为0.03mol·L-1,当Fe3+沉淀完全时(c(Fe3+)为1×10-5mol·L-1),Al3+是否已经开始沉淀,请通过计算说明______________。
(3)写出滤渣1加NaOH溶液发应的离子方程式_____________________。
(4)滤渣2中加过量盐酸的目的是_____________________________。
(5)FeCl3具有净水作用,但易腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
①FeCl3净水的原理是________。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)_________。
②FeCl3在溶液中分三步水解:Fe3++H2O![]() Fe(OH)2++H+ K1,Fe(OH)2++H2O
Fe(OH)2++H+ K1,Fe(OH)2++H2O![]() Fe(OH)2++H+ K2,Fe(OH)2++H2O
Fe(OH)2++H+ K2,Fe(OH)2++H2O![]() Fe(OH)3+H+ K3,以上水解反应的平衡常数K1、K2、K3由大到小的顺序是_______。
Fe(OH)3+H+ K3,以上水解反应的平衡常数K1、K2、K3由大到小的顺序是_______。
③通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)_____。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)_____。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”备受关注,CO2的排集、利用与封存成为科学家研究的重要课题。
(1)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应
CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
①已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) △H1=-802kJ·mol-1
CO(g)+1/2O2(g)===CO2(g) ΔH2=-283kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g) △H3=-41kJ·mol-1
则反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的△H=___________。
2CO(g)+2H2(g)的△H=___________。
(2)为了探究反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的反应速率和平衡。起始时,向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol·L-1
2CO(g)+2H2(g)的反应速率和平衡。起始时,向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol·L-1
①平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图):v正(CO2)和v逆(CO),则与v正(CO2)相对应的是图中曲线___________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度反应重新达到平衡,则此时曲线甲对应的平衡点可能为___________(填“D”“E”或“F”),判断的理由______________________。

②又测得CH4的平衡转化率与温度及压强的关系如图,当压强为P2时,在y点:v(正)___________v(逆)(选填“大于”、“小于”或“等于”);压强p1___________p2(选填“大于”、 “小于”或“等于”),原因是___________;
若p2=6MPa,则T℃时该反应的平衡常数Kp=___________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、![]() 的混合液,经测定溶液中
的混合液,经测定溶液中![]() 与
与![]() 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的![]() 的分子个数比为( )
的分子个数比为( )
A.21:5B.11:3C.5:1D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着低碳钢等洁净钢技术的发展,![]() 耐火材料和钢水之间的相互作用已成为当前的一个研究重点。
耐火材料和钢水之间的相互作用已成为当前的一个研究重点。
请回答下列问题:
(1)日常生活中铝用品比铁器件更耐腐蚀,原因是________。
(2)在埋炭实验条件下,不同碳素材料的![]() 耐火材料与铁液之间的可能反应如下:
耐火材料与铁液之间的可能反应如下:
①![]()
![]() ;
;
②![]()
![]() ;
;
③![]()
![]() ;
;
则![]() 的
的![]() ______
______![]() 。
。
(3)实验温度下,(![]() )/Fe系统中存在着相互反应,如
)/Fe系统中存在着相互反应,如![]() 溶入铁液中,导致铁液中平衡的铝的百分含量的对数(lg[Al])和平衡氧(
溶入铁液中,导致铁液中平衡的铝的百分含量的对数(lg[Al])和平衡氧(![]() )的百分含量的对数(lg[
)的百分含量的对数(lg[![]() ])关系如图所示,图中温度
])关系如图所示,图中温度![]() ___1973K(填“>”或“<”).
___1973K(填“>”或“<”).

(4)在埋炭情况下,碳过剩时,碳的氧化反应主要考虑:![]() 。在实验室研究该反应,一定温度下.向某体积可变的恒压密闭容器(总压强为
。在实验室研究该反应,一定温度下.向某体积可变的恒压密闭容器(总压强为![]() )加入足量的碳和1mol
)加入足量的碳和1mol![]() ,平衡时体系中气体体积分数与温度的关系如图所示:
,平衡时体系中气体体积分数与温度的关系如图所示:

①650℃时,该反应达到平衡后吸收的热量是_____,清耗碳的质量为____。
②T℃时,若向平衡体系中再充入一定量以V![]() ):V(
):V(![]() )=5:4的混合气体,平衡___(填“向正反应方向”“向逆反应方向”或“不”)移动。
)=5:4的混合气体,平衡___(填“向正反应方向”“向逆反应方向”或“不”)移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数![]() =__[用含
=__[用含![]() 的代数式表示,气体分压(
的代数式表示,气体分压(![]() )=气体总压(
)=气体总压(![]() )X体积分数]。
)X体积分数]。
(5)CO可作某熔融盐电池的燃料,电解质为![]() 和
和![]() 的熔融盐混合物,空气与
的熔融盐混合物,空气与![]() 的混合气为助燃气,电池在650℃下工作时,负极的电极反应式为________。
的混合气为助燃气,电池在650℃下工作时,负极的电极反应式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com