
| C | N | O | F | |
| Si | P | S | Cl | |
| Ge | As | Se | Br | |
| Sn | Sb | Te | I | |
| Pb | Bi | Po | At |
| 4.48L |
| 22.4L/mol |
| 14.4g |
| 18g/mol |
| 35.2g |
| 44g/mol |
| 4.48L |
| 22.4L/mol |
| 14.4g |
| 18g/mol |
| 35.2g |
| 44g/mol |
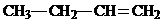 、
、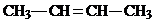 、
、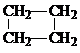 、
、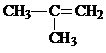 ,
,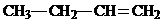 ;
;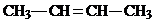 ;
;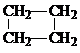 ;
;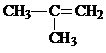 .
.


科目:高中化学 来源: 题型:
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O |
| D、碳酸钡溶于醋酸:BaCO3+2H+═Ba2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
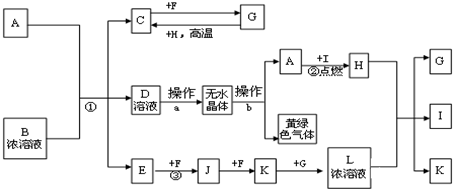
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、阴影部分元素在周期表中处于第ⅣA族 |
| B、H3AsO4的酸性大于H3PO4 |
| C、元素铊(Tl)的最高价氧化物的水化物的碱性:Tl(OH)3<Al(OH)3 |
| D、元素砹(At)为有色固体,难与氢气化合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com