
| A、在化合物SiC中,Si显正价、C显负价是因为C的电负性大于Si的电负性 |
| B、由于H与F的电负性差值为1.9大于1.7,所以HF是离子化合物 |
| C、基态C原子有两个未成对电子,所以最多只能形成2个共价键 |
| D、所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性 |


科目:高中化学 来源: 题型:
| 选项 | 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 |
| A | 水煤气 | 大理石 | 苛性钠 | 醋酸 | 二氧化碳 |
| B | 胆矾 | 空气 | 硫酸钠 | 一水合氨 | 石墨 |
| C | 生石灰 | 水煤气 | 盐酸 | 碳酸 | 铜 |
| D | 烧碱 | 汽油 | 硫酸钡 | 水 | 乙醇 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
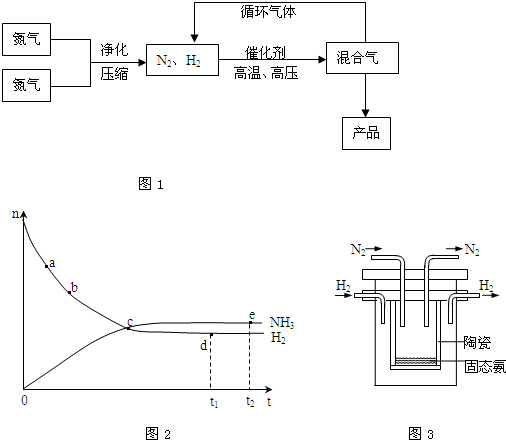
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 俗话说“酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室,我们可以用下图所示的装置来制取乙酸乙酯.回答下列问题:
俗话说“酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室,我们可以用下图所示的装置来制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
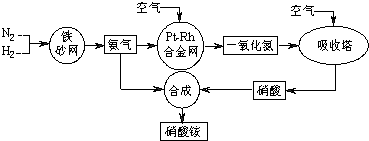
查看答案和解析>>
科目:高中化学 来源: 题型:
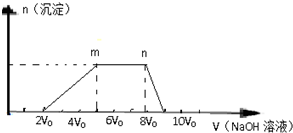 1L某混合溶液,可能含有的离子如下表:
1L某混合溶液,可能含有的离子如下表:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、Al(OH)4-(或AlO2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(K+)≥0.2 mol/L |
| B、一定存在的离子:Cl- CO32-、SO42- NH4+ |
| C、一定不存在的离子:Ca2+ K+ Cl- |
| D、c(K+)+c(NH4+)=c(CO32-)+c(SO42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com