
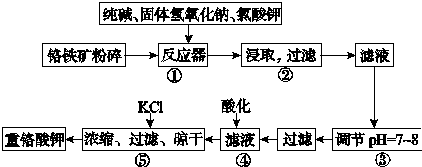
分析 (1)氧化剂是反应中化合价降低的物质,在反应Ⅰ中KClO3中的氯元素化合价从+5降到-1,为氧化剂,245g KClO3的物质的量为2mol,则转移电子的物质的量为12mol,即12 NA;
(2)CrO42-、Cr2O72-的颜色分别为黄色、橙色,所以现象为溶液由黄色变为橙色,反应的离子方程式为 2CrO42-+2H+=Cr2O72-+H2O;
(3)萃取分液适用于互不相溶的液体,蒸馏适用于沸点相差较大的互溶液体,而重结晶法是利用物质不同温度下溶解度的不同,分离提纯待重结晶物质的过程,所以选择A;
(4)硫酸酸化的K2Cr2O7与KI反应,根据氧化还原反应理论,得化学反应方程式K2Cr2O7+7H2SO4+6KI=Cr2(SO4)3+3I2+7H2O+4K2SO4.
解答 解:(1)氧化剂是反应中化合价降低的物质,在反应Ⅰ中KClO3中的氯元素化合价从+5降到-1,为氧化剂,245g KClO3的物质的量为2mol,则转移电子的物质的量为12mol,即12 NA ,
故答案为:KClO3;12NA;
(2)CrO42-、Cr2O72-的颜色分别为黄色、橙色,所以现象为溶液由黄色变为橙色,反应的离子方程式为 2CrO42-+2H+=Cr2O72-+H2O,
故答案为:溶液由黄色变为橙色;2CrO42-+2H+=Cr2O72-+H2O;
(3)萃取分液适用于互不相溶的液体,蒸馏适用于沸点相差较大的互溶液体,而重结晶法是利用物质不同温度下溶解度的不同,分离提纯待重结晶物质的过程,所以选择a,
故答案为:a;
(4)硫酸酸化的K2Cr2O7与KI反应,根据氧化还原反应理论,得化学反应方程式K2Cr2O7+7H2SO4+6KI=Cr2(SO4)3+3I2+7H2O+4K2SO4.
故答案为:K2Cr2O7+7H2SO4+6KI=Cr2(SO4)3+3I2+7H2O+4K2SO4.
点评 本考查氧化剂的判断、电子转移数目的计算、化学方程式的推断、离子方程式的书写以及物质提纯方法.


科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{ρ•w}{M}$ | B. | c=$\frac{ρ•M}{w}$ | C. | c=$\frac{M}{m•V}$ | D. | c=$\frac{m}{M•V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L Cl2完全溶于水时,转移电子数为NA | |
| B. | 常温下,0.1mol/L NH4NO3溶液中NO3-的数目为0.1NA | |
| C. | 室温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 常温下,23g NO2和N2O4的混合气体中含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、I-、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-=Fe2++I2 | |
| C. | 1L0.1mol/L该溶液和足量的Zn充分反应,生成11.2gFe | |
| D. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com