
| A. | 铝热反应原理是炼铁最常用的反应原理 | |
| B. | 氧化铝熔点很高,可用作耐火材料 | |
| C. | 过氧化钠可以用作呼吸面具中的供氧剂 | |
| D. | 青铜是我国使用最早的合金 |
分析 A、炼铁常用一氧化碳还原氧化铁的热还原法;
B、可作耐火材料的物质,其熔点高;
C、过氧化钠和二氧化碳反应生成碳酸钠和氧气;
D、人类最早使用的合金是由铜、锡形成的青铜.
解答 解:A、铝热反应用来冶炼熔点高的金属,如钒、铬、锰等,而炼铁最常用的方法为热还原法,故A错误;
B、因Al2O3熔点很高,一般温度下不能液化,则可用作耐火材料,故B正确;
C、过氧化钠和呼出气体二氧化碳反应生成碳酸钠和氧气,用作呼吸面具中的供氧剂,故C正确;
D、人类最早使用的合金是由铜、锡形成的青铜,故D正确.
故选A.
点评 本题考查元素化合物的性质,涉及钠及其化合物及铝的化合物的性质,注意物质的性质与用途的关系及金属冶炼原理,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 变化过程中化学键被破坏,则一定发生化学变化 | |
| B. |  实验室制氧气 | |
| C. | Na+、Fe3+-人体所需微量元素 | |
| D. | 能区别地沟油与矿物油的方法是加入足量氢氧化钠溶液共热,不分层的是地沟油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用燃着的木条伸入集气瓶中检验二氧化碳 | |
| B. | 用水区分氢氧化钠固体和氯化钠固体 | |
| C. | 用铁粉除去FeSO4溶液中混有的CuSO4 | |
| D. | 用石灰水除去NaOH溶液中混有的Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数为NA的CO和N2的混合气体体积为22.4L,平均相对分子质量为28 | |
| B. | 体积不变的容器中进行的反应N2+3H2$?_{高温高压}^{催化剂}$2NH3,随着反应的进行气体密度逐渐减小 | |
| C. | Na2O2和NH4Cl浓溶液反应得到混合气体的平均相对分子质量可能是34 | |
| D. | 对于反应I2(g)+H2(g)$\stackrel{△}{?}$2HI(g)而言,达到平衡后,气体的平均相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
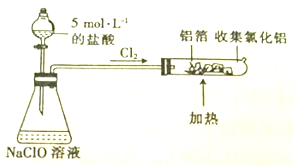
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 中学化学中几种常见物质的转化关系如图所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体.请回答下列问题:
中学化学中几种常见物质的转化关系如图所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者都为s-sσ键 | B. | 两者都为p-pσ键 | ||
| C. | 前者为p-pσ键,后者为s-pσ键 | D. | 前者为s-sσ键,后者为s-pσ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
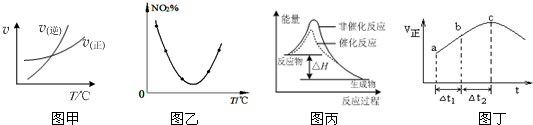
| A. | 由图甲表示的反应速率随温度变化的关系可知该反应的△H>0 | |
| B. | 图乙表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)═N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| C. | 图丙表示该反应为放热反应,且催化剂能改变反应的焓变 | |
| D. | 绝热恒容密闭容器中发生反应:SO2(g)+NO2(g)?SO3(g)+NO(g),其正反应速率随时间变化如图丁所示,则c点一定是平衡点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2与足量的Fe充分反应,转移电子的数目为3NA | |
| B. | 常温下,1 L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| C. | 常温下,21 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1 mol ${\;}_{6}^{14}$C原子中所含中子数目为6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com