
| A. | 乙醇制乙醛、乙酸制乙酸乙酯均为取代反应 | |
| B. | 乙烯制聚乙烯、苯制硝基苯均发生加聚反应 | |
| C. | 蛋白质盐析、糖类水解均为化学变化 | |
| D. | 石油分馏、煤干馏均可得到烃 |
分析 A.乙醇中-OH转化为-CHO,生成乙醛;
B.苯中H被硝基取代;
C.盐析降低溶解度,为物理变化;
D.石油分馏产品中含汽油、煤油,均为烃类物质;煤干馏发生化学变化生成苯等有机物.
解答 解:A.乙醇中-OH转化为-CHO,生成乙醛,为氧化反应,而乙酸制乙酸乙酯为取代反应,故A错误;
B.苯中H被硝基取代,为取代反应,而乙烯制聚乙烯为加聚反应,故B错误;
C.盐析降低溶解度,为物理变化,而糖类水解生成单糖为化学变化,故C错误;
D.石油分馏产品中含汽油、煤油,均为烃类物质;煤干馏发生化学变化生成苯等有机物,石油分馏、煤干馏均可得到烃,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成、结构与性质、有机反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热用△H3表示,则△H3<△H1 | |
| B. | 碳的燃烧热用△H3表示,则△H3>△H1 | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热值为57.3kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量57.3KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
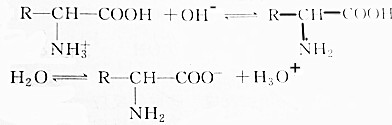
| A. | 增大溶液的pH,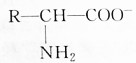 浓度减小 浓度减小 | |
| B. | 降低溶液的pH,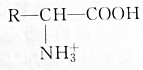 浓度减小 浓度减小 | |
| C. | 如溶液的pH适当,两种氨基酸离子的浓度可能相同 | |
| D. | pH改变,对电离方式无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40.625 | B. | 42.15 | C. | 38.225 | D. | 42.625 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
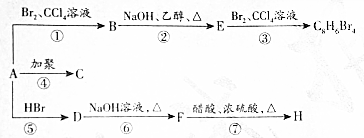
 ,D
,D ,E
,E .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O(消去反应).
+2NaBr+2H2O(消去反应). +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaBr(取代反应).
+NaBr(取代反应).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把aL0.1mol/L的CH3COOH溶液与bL0.1mol/L的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)═c(CH3COO-)+c(OH-) | |
| B. | 把0.1mol/L的NaHCO3溶液与0.3mol/L的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba+)>c(Na+)>c(H+) | |
| C. | 向1mol/L的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| D. | 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ABCDE五种溶液分别是NaOH溶液、氨水、醋酸、盐酸、NH4HSO4溶液的一种.常温下进行下列实验:
ABCDE五种溶液分别是NaOH溶液、氨水、醋酸、盐酸、NH4HSO4溶液的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中失去电子的电极为阳极 | |
| B. | 原电池的两极一定是由活动性不同的两种金属组成 | |
| C. | 电解时电解池的阳极一定是阴离子放电 | |
| D. | 原电池的负极、电解池的阳极都发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com