
【题目】下列导电能力最差的电解质
A. 熔融的NaOH B. 硫磺 C. 石墨棒 D. KNO3晶体
科目:高中化学 来源: 题型:
【题目】某废液中含有Fe3+、Cu2+、Ag+金属离子,某研究小组设计的处理方案如下(假如各步骤所加试剂都过量):
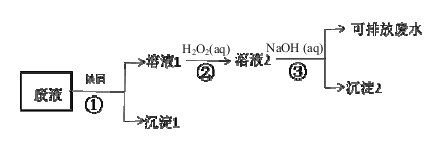
(1)沉淀1的主要成分是_________(用元素符号表示),沉淀2化学式为___ ___。
(2)步骤②发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,该反应中氧化产物为________,若有3mol FeS2参加反应,转移电子的物质的量为_______.
6SO2+Fe3O4,该反应中氧化产物为________,若有3mol FeS2参加反应,转移电子的物质的量为_______.
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________.
(3)将一定量的Fe2O3溶于160mL 5molL﹣1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率说法正确的是
A.化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加
B.根据化学反应速率的大小可以知道化学反应进行的快慢
C.化学反应速率0.8 mol/(L·s)是指1 s时某物质的浓度为0.8 mol/L
D.对于任何化学反应来说,反应速率越大,反应现象就越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一元弱酸(用HA表示)在水中的电离方程式是:HA![]() H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向___________(填“正”、“逆”)反应方向移动。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向___________(填“正向”、“逆向”、或“不移动”)移动,溶液pH将___________中(填“增大”、“减小”或“不变”),溶液中![]() 比值___________(填“增大”、“减小”或“不变”).
比值___________(填“增大”、“减小”或“不变”).
(3)在25℃下,将a molL-1的氨水与0.01molL-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液呈中性,用含a的代数式表示NH3H2O的电离常数Kb=___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入氢氧化钾溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO﹣与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A. 2:3 B. 4:3 C. 10:3 D. 11:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为钠硫高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS![]() Na2Sx,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 倍。
Na2Sx,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 倍。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com