
【题目】维生素是构成生命的基础物质.在鸡蛋、蔬菜、大米等食物中,富含维生素的是 .“84消毒液”在日常生活中被广泛使用.该消毒液无色,对某些有色物质具有漂白作用,它的有效成分是 (填“KMnO4”或“NaClO“).
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注。据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN)。爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染。
资料:氰化钠白色结晶颗粒、易潮解、有微弱的苦杏仁气味、剧毒、易溶于水、易水解生成氰化 氢、水溶液呈碱性。
(1)白磷有毒,能和氯酸溶液发生氧化还原反应:3P4 +10HC1O3 +18H2 O=10HC1+12H3 PO4,该反应的氧化产物是 ,若有1 mo1 P4参加反应转移电子为 mol。
(2)氰化钠(NaCN)是一种化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理等方面。
①已知:25℃时,HCN的电离平衡常数Ka = 6.2×10-10,H2CO3在25℃时的电离平衡常数是Ka1=4.5×10-7 Ka2=4.7×10-11,则向NaCN溶液通入少量CO2反应方程式是: 。
②常温下,氰化钠能与过氧化氢溶液反应,生成碳酸氢钠和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是: 。
(3)实验室通过如图所示装置制备Na2SO3。

装置a中盛装Na2SO3固体的仪器名称是 ;装置b的作用是 。
(3)装置c中的产物有Na2S2O3和CO2气体等,实验结束后,装置d中的溶质有NaOH、Na2CO3,还可能有 。
(4)实验结束后,在e处最好连接盛 (选填“NaOH溶液”、“水”、“CC14”中任一种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向300mL 2.0mol·L-1盐酸中加入几小块大理石,产生气体的体积随时间的变化曲线如右图所示(气体体积均在标准状况下测定)试回答下列问题:
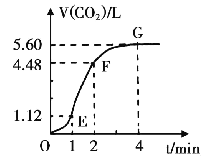
(1)若以反应中消耗的HCl表示反应速率,设OE段的反应速率为v1,EF段的反应速率为v2,FG段的反应速度为v3,则v1v2v3从大到小的顺序为 ,其中造成v1和v2大小关系的主要原因是
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是 (填编号)
A.蒸馏水 B.Na2CO3 C.氯化钠溶液 D.浓盐酸
(3)若反应过程中溶液体积的变化忽略不计,则EF段用盐酸表示的化学反应速率v(HCl)= ______mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.B.C.D.E.F之间存在如图的转化关系(部分物质及反应条件已略去),A.是一种气体肥料,D中含有人体中含量最高的金属元素。
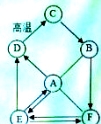
(1)请写出相关的化学式及化学方程式:
A D
C→B
E→F
(2)图示转化关系中未涉及到的基本反应类型是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做完实验后,采用以下方法分别清洗所用仪器,其中清洗方法不合理的是( )
A. 用酒精清洗做过碘升华的烧杯
B. 用水清洗做过银镜反应的试管
C. 用浓盐酸清洗做过高锰酸钾分解实验的试管
D. 用氢氧化钠溶液清洗盛过苯酚的试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成
水煤气,化学反应方程式为 。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反
应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
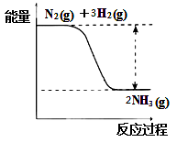
①合成氨的反应中的能量变化如右图所示。
该反应是 反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量 (填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是 (填序号)。
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键
C. N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)
+3H2(g)![]() CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
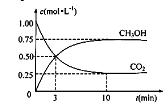
①从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)= 。
②达平衡时容器内平衡时与起始时的压强之比 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺如下(部分操作和条件略):
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧。
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A。
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B。
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5。
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体。
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
FeOCr2O3 + Na2CO3 + ![]() Na2CrO4 + Fe2O3 + CO2↑;
Na2CrO4 + Fe2O3 + CO2↑;
②Na2CO3+Al2O3=2NaAlO2+CO2↑。
(2)固体A中主要含有 (填写化学式)。
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O。Ⅳ中调节溶液pH<5时,其目的是 。
Cr2O72-+H2O。Ⅳ中调节溶液pH<5时,其目的是 。
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知下表数据
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度 (g/100g水) | 0℃ | 28[来 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
①该反应能发生的理由是 。
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、 、 、过滤、洗涤、干燥得到晶体。
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量________(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为______ (用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于化学变化的是( )
A.向饱和的硫酸铵溶液中滴加蛋清溶液
B.日本核电站工作人员给核电机组注水降温
C.炼油厂蒸馏原油获得汽油、煤油等产品
D.露置于空气中的镁带表面逐渐变黑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com