
分析 该反应中化合价的变化为:KIO3→I2,I元素由+5价→0价,;KI→I2,I元素由-1价→0价,依据氧化还原反应的元素化合价变化升低相同,结合质量守恒配平.
解答 解:该反应中化合价的变化为:KIO3→I2,I元素由+5价→0价,一个KIO3分子得5个电子;KI→I2,I元素由-1价→0价,一个KI分子失一个电子,所以得失电子的最小公倍数为5,KIO3的计量数为1,KI的计量数为5,其它元素根据原子守恒配平,所以反应方程式为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,
故答案为:1;5;3;3;3;3.
点评 本题考查了氧化还原反应方程式的配平,题目难度不大,注意根据化合价的变化以及得失电子守恒、原子守恒配平.


科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 标况下气体的摩尔体积约为22.4升 | |
| C. | 1L0.5mol/LFeCl3的溶液与0.2L1mol/LKCl溶液中Cl-数目之比为15:2 | |
| D. | 100mL1mol/LNaCl溶液与50mL1mol/LAlCl3溶液中Cl-物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
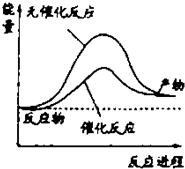
| A. | 如图可表示水分解过程中的能量变化 | |
| B. | 若2C(s)+O2(g)=2CO(g)△=-221.0kJ/mol,则碳的燃烧热为110.5kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知I:反应H2(g)+Cl2(g)=2HCl(g)△=-akJ/mol II:  且a、b、c均大于零,则断开1mol H-Cl键所需的能量为(-a-b-c)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 | |
| B. | 变价金属一定是过渡元素 | |
| C. | 不含金属元素的化合物也可能是离子化合物 | |
| D. | 显酸性的溶液中溶质只能是酸或强酸弱碱盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
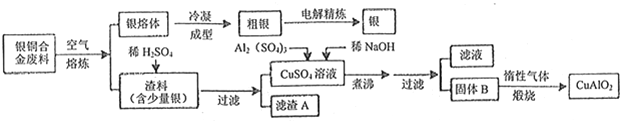
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 嫦娥一号 | 液氢(H2) | ①2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 ②2H2(l)+O2(l)=2H2O(g)△H=-482.6kJ•mol-1 |
| 祥云火炬 | 丙烷 (C3H8) | ③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1 ④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,18gH218O所含质子数为10NA | |
| B. | 1 mol乙醇中含有极性键的数目为8NA | |
| C. | 1mol的-NH2与1molNH4+所含电子数均为10NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15mol•L-1 | B. | 10mol•L-1 | C. | 5mol•L-1 | D. | 1mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com