
| A. | 11.1% | B. | 22.2% | C. | 33.3% | D. | 37.8% |
分析 当充人lmolH2O(g)和1molCO (g)反应达到平衡时,有$\frac{1}{2}$的CO转化为CO2.可计算反应的平衡常数,在相同条件下,若将1molCO(g)和2mol H2O(g)重新充入同一反应容器中,反应的化学平衡常数不变,可根据平衡常数计算该题.
解答 解:CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol) 1 1 0 0
转化(mol) 0.5 0.5 0.5 0.5
平衡(mol) 0.5 0.5 0.5 0.5
K=1,
在相同条件下,若将1molCO(g)和2mol H2O(g)重新充入同一反应容器中,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol) 1 2 0 0
转化(mol)x x x x
平衡(mol) 1-x 2-x x x
$\frac{{x}^{2}}{(1-x)(2-x)}$=1,
X=$\frac{2}{3}$.
混合气体中CO2的体积分数可能为$\frac{\frac{2}{3}}{3}×100%$=22.2%.
故选B.
点评 本题考查化学平衡计算,为高频考点,题目难度中等,注意把握化学平衡常数的运用,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 1000mL 2.5mol/L NaCl 溶液 | B. | 300mL 5mol/L KClO3溶液 | ||
| C. | 250mL 1mol/L AlCl3溶液 | D. | 200mL 2mol/L MgCl2 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n=2 | |
| B. | 第一次达平衡时,反应消耗的A为0.7 mol | |
| C. | 充入氮气后,反应速率加快,平衡正向移动 | |
| D. | 正反应放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.7% | B. | 50% | C. | 66.7% | D. | 83% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
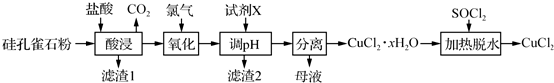
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡后CO的体积分数为40% | |
| B. | 平衡后CO的转化率为25% | |
| C. | 平衡后水的转化率为50% | |
| D. | 平衡后混合气体的平均相对分子质量为24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com