
分析 明矾的化学式为KAl(SO4)2•12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42-,根据反应:SO42-+Ba2+=BaSO4↓、Al3++4OH-=AlO2-+2H2O判断.
解答 解:明矾的化学式为KAl(SO4)2•12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42-,由反应SO42-+Ba2+=BaSO4↓可知,使SO42-全部转化成BaSO4沉淀,需要2molBa(OH)2,则加入4molOH-,则发生Al3++4OH-=AlO2-+2H2O,所以最后溶液中存在AlO2-,故答案为:AlO2-.
点评 本题考查离子方程式的书写,题目难度中等,本题中注意判断使SO42-全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH-物质的量的关系判断反应产物.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,NH3(g)、O2(g) NO(g)、H2O(g)的浓度比为4:5:4:6 | |
| D. | 化学反应速率关系是:2v正(NH3)=3v正(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配溶液时,容量瓶里有少许蒸馏水不会影响溶液浓度 | |
| B. | NaHCO3•10H2O晶体灼烧后,得到NaHCO3粉末 | |
| C. | 实验室用氯酸钾制氧气的反应不属于离子反应 | |
| D. | 要使AlCl3溶液中的Al3+离子全部沉淀出来,用氨水比用NaOH溶液好 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
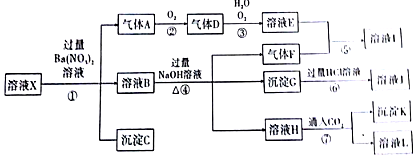
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的溶液中:NH4+、K+、CO32-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I- | |
| C. | 无色透明水溶液中:K+、Ba2+、I-、NO3- | |
| D. | 与铝粉反应有氢气生成的溶液中:Na+、Cl-、SO42-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com