
| 0.2 |
| 2 |
| 0.18 |
| 2 |
| 0.18 |
| 2 |
| 0.18 |
| 2 |
| 1.0×10-19 |
| 0.18 |
| 2 |
| 0.2 |
| 2 |
| 1.0×10 -19 |
| 0.01 |
| 0.2mol/L |
| 2 |


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1个 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的族序数与周期数的差为4,且不与A元素在同一周期 |
| E位于周期表中第七列 |
| F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用氯气进行自来水的杀菌消毒:Cl2+H2O═HCl+HClO |
| B、将“NO2球”浸泡在热水中,颜色变深:2NO2(g)═N2O4(g)△H<0 |
| C、在刻制印刷电路板时,用FeCl3溶液腐蚀铜箔:2Fe3++3Cu═2Fe+3Cu2+ |
| D、在KNO3和稀硫酸混合液中,铜片溶解:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
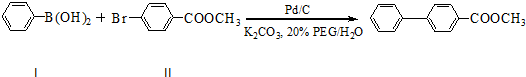

查看答案和解析>>
科目:高中化学 来源: 题型:
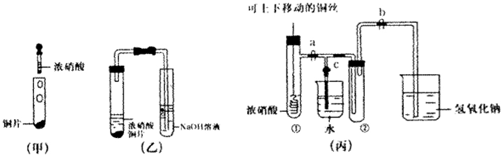
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
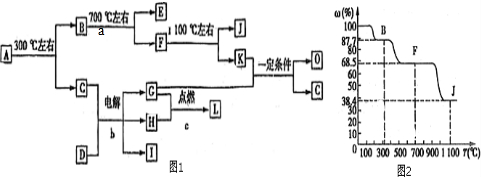
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
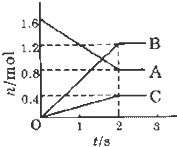 某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com