
| A. | CH3CH2CH2CH2CH2Cl | B. | CH3CH2CHClCH2CH3 | ||
| C. | 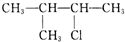 | D. | 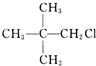 |
分析 根据能跟H2加成生成2-甲基丁烷,说明Y和Z均为分子中含5个C原子的不饱和烃,其碳骨架为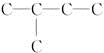 .氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基,以此解答该题.
.氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基,以此解答该题.
解答 解:根据能跟H2加成生成2-甲基丁烷,说明Y和Z均为分子中含5个C原子的不饱和烃,其碳骨架为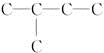 ,氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基.
,氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基.
A.CH3CH2CH2CH2Cl没有支链,故A错误;
B.(CH3)2CHCH2CH2Cl发生消去反应只生成一种烯烃,故B错误;
C.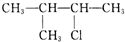 含有一个支链甲基,发生消去反应生成两种烯烃:(CH3)2C=CHCH3;CH2=C(CH3)CH2(CH3),故C正确;
含有一个支链甲基,发生消去反应生成两种烯烃:(CH3)2C=CHCH3;CH2=C(CH3)CH2(CH3),故C正确;
D. 有两个支链,故D错误;
有两个支链,故D错误;
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,熟悉卤代烃消去的规律和烯烃的加成特点是解题的关键,难度不大.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=1的NaHSO4溶液:c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 向10mL pH=l2的NaOH溶液中滴加等体积pH=2的CH3COOH:c(CH3COO-)>c(Na+)>c(OH-)>C(H+) | |
| C. | 0.10 mol•L-1 NaHCO3溶液加水稀释后,n (H+)与n (OH-)的乘积变大 | |
| D. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合溶液显碱性:c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
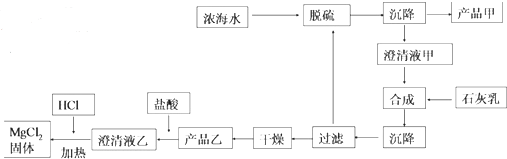
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应的热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-Q1 kJ/mol | |
| B. | 相同条件下1mol N2(g)和3mol H2(g 的总键能小于2molNH3(g)的总键能 | |
| C. | 相同条件下将2molN2和6molH2置于相同容器中充分反应后放出的热量为Q2 kJ,Q2=2Q1 | |
| D. | 相同条件下气体密度不变时,可以判断反应N2(g)+3H2 (g)═2NH3 (g)达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
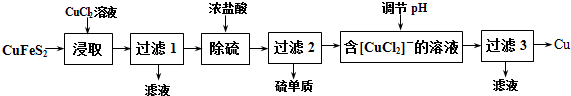
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、OH-、Na+、Cl- | B. | K+、NO3-、Cu2+、Cl- | ||
| C. | Ba2+、SO42-、Na+、OH- | D. | Fe3+、OH-、NH4+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
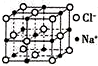 由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症.
由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症. ,未成对电子数为5.
,未成对电子数为5.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com