
| A. | 在水中的溶解性:NaHCO3<Na2CO3 | |
| B. | 相同条件下,与等浓度盐酸反应生成CO2的速率:NaHCO3<Na2CO3 | |
| C. | 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3放出CO2更多 | |
| D. | 等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应产生的CO2质量相同 |
分析 A.相同条件下,碳酸铵的溶解度大于碳酸氢钠的溶解度;
B.碳酸氢钠和盐酸的反应速率快于碳酸钠和盐酸的反应速率;
C.等质量的Na2CO3和NaHCO3,碳酸钠的摩尔质量大,其物质的量少;
D.根据碳酸钠和碳酸氢钠与足量的盐酸反应时碳元素守恒来计算.
解答 解:A.向饱和碳酸钠溶液中通入二氧化碳析出碳酸氢钠晶体,则相同条件下,在水中的溶解性为NaHCO3<Na2CO3,故A正确;
B.碳酸氢钠和盐酸一步反应,而碳酸钠和盐酸反应分步完成,所以与盐酸反应的速率为NaHCO3>Na2CO3,故B错误;
C.等质量的Na2CO3和NaHCO3,碳酸钠的摩尔质量大,其物质的量少,盐酸足量,则与盐酸完全反应,碳酸钠产生的气体少,故C正确;
D.碳酸钠和碳酸氢钠与足量的盐酸反应时,根据碳元素守恒,等物质的量的Na2CO3、NaHCO3中C的量相等,均生成二氧化碳,所以生成二氧化碳的量相等,故D正确.
故选B.
点评 本题考查碳酸钠和碳酸氢钠性质的比较,为高频考点,把握二者性质的差异是解答的关键,注意知识的积累和灵活应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
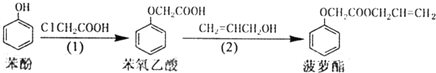
| A. | 步骤(1)、(2)的反应类型不同 | |
| B. | 步骤(1)产物中残留的苯酚能用FeCl3溶液检验 | |
| C. | 苯氧乙酸和菠萝酯均可与氢氧化钠溶液反应 | |
| D. | 步骤(2)产物中残留的烯丙醇不能用溴水检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 回答下列问题.
回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
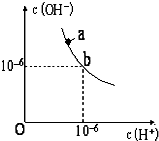
| A. | pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):③>②>① | |
| B. | 0.2mol•L-1 CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| C. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 常温下,向0.1mol/L NH4HSO4溶液中滴加NaOH溶液至中性c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C2H2(g)+$\frac{5}{2}$O2(g)→2CO2(g)+H2O(l)△H=-1300KJ/mol 当有5NA个电子转移时能放出650KJ的热量 | |
| B. | 有28g乙烯与丙烯混合气体,其含原子总数为3NA个 | |
| C. | 有反应H2(g)+I2(g)?2HI(g)△H=-QHJ/mol在298K 101KPa下向一密闭容器中充入NA个H2和NA个I2,充分反应共放出热量为QKJ | |
| D. | 在78g苯中含3NA个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
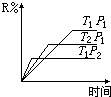 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )| A. | 正反应吸热,S是气体 | B. | 正反应吸热,S是固体 | ||
| C. | 正反应放热,S是气体 | D. | 正反应放热,S是固体或液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 四种短周期元素中W的原子半径最小 | |
| B. | Z元素在周期表中的位置是第三周期第ⅣA族 | |
| C. | 原子最外层电子数由多到少的顺序:Y>X>W>Z,最高正价由高到低顺序:W>Z | |
| D. | 元素非金属性由强到弱的顺序:W>Z,W的单质常温下可与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com