
 .
.分析 (1)铁置换出Cu,Cu置换出Ag,氧化还原反应中还原剂的还原性大于还原产物的还原性,氧化剂的氧化性大于氧化产物分析;
有元素化合价变化的反应为氧化还原反应,含元素的化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂.
(2)根据氧化还原反应中化合价升高的是还原剂,降低的是氧化剂,根据发生化合价变化的量判断还原剂与氧化剂的关系,及转移电子数,根据化学方程式书写离子方程式;
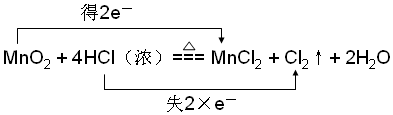
(3)MnO2与浓盐酸共热反应生成MnCl2、Cl2和H2O,锰元素化合价从+4价降低到+2价;得到电子被还原;HCl中的氯元素化合价从-1价升高到0价失去电子被氧化;
(4)反应中稀HNO3具有强氧化性为反应物生成NO,N元素化合价由+5价降低为NO中+2价,共降低3价,Cu2S具有强还原性为反应物生成Cu(NO3)2和H2SO4,Cu2S中Cu元素化合价由+1价升高为+2价、S元素化合价由-2升高为+6,总共升高10价,化合价最小公倍数为30,故Cu2S的系数为3,NO的系数为10,据此书写.
解答 解:(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则铁置换出Cu,Cu置换出Ag,所以还原剂Fe>Cu>Ag,故还原性最强的是Fe;Cu2+、Fe2+、Ag+中氧化性强弱为Ag+>Cu2+>Fe2+,氧化性最强的是Ag+;
故答案为:Fe;Ag+;
(2)已知Al+HNO3=Al(NO3)3+NO↑+H2O,HNO3→NO,氮元素化合价从+5降低为+2,HNO3是氧化剂,1molAl从0价升高为+3价,Al是还原剂,根据得失电子守恒配平方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O;
1molAl从0价升高为+3价,失去3mol电子,1molHNO3化合价从+5降低为+2得到3mol电子,所以还原剂与氧化剂的物质的量相等之比是1:1;
n(Al)=$\frac{m}{M}$=$\frac{5.4g}{27g/mol}$=0.2mol,所以转移电子的物质的量为0.2mol×3=0.6mol;
Al和4HNO3反应的离子方程式为Al+4H++NO3-=Al3++NO↑+2H2O,
故答案为:HNO3;1:1;0.6mol;Al+4H++NO3-=Al3++NO↑+2H2O;
(3)MnO2与浓盐酸共热反应生成MnCl2、Cl2和H2O中锰元素化合价从+4价降低到+2价;得到电子被还原;HCl中的氯元素化合价从-1价升高到0价失去电子被氧化;电子转移双线桥标为: ;
;
故答案为:
(4)反应中稀HNO3具有强氧化性为反应物生成NO,N元素化合价由+5价降低为NO中+2价,共降低3价,Cu2S具有强还原性为反应物生成Cu(NO3)2和H2SO4,Cu2S中Cu元素化合价由+1价升高为+2价、S元素化合价由-2升高为+6,总共升高10价,化合价最小公倍数为30,故Cu2S的系数为3,NO的系数为10,再利用原子守恒,则方程式为:3Cu2S+22HNO3(稀)═6Cu(NO3)2+10NO↑+3H2SO4+8H2O,
故答案为:3Cu2S+22HNO3(稀)═6Cu(NO3)2+10NO↑+3H2SO4+8H2O.
点评 本题考查氧化还原反应基本概念的分析和电子转移计算应用,掌握基础是关键,题目难度中等,抓住反应前后化合价变化是解题的关键.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
已知一定条件下断裂1 mol下列化学键生成气态原子需要吸收的能量如下:H—H 436 kJ;Cl—Cl 243 kJ;H—Cl 431 kJ。下列所得热化学方程式或结论正确的是( )
A.H(g)+Cl(g)=HCl(g)ΔH=﹣431kJ·mol-1
B.2HCl(g)=H2(g)+Cl2(g)的反应热ΔH<0
C.H 2(g)+Cl2(g)=2HCl(g)ΔH=﹣183kJ
2(g)+Cl2(g)=2HCl(g)ΔH=﹣183kJ
D.相同条件下,H2(g)+Cl2(g)=2HCl(g)反应在光照和点燃条件下的ΔH不相等
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g);△H<0.
氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g);△H<0.| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离产生的c(H+)=10-12 mol•L一1的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | 常温下,pH=7的溶液中:Al3+、Cl-、HCO3-、SO42- | |
| C. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Cu2+、S2-、Cl- | |
| D. | pH=1的溶液中:Fe3+、NO3-、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com