


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
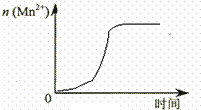 ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺
ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺| ʵ���� | �¶�/�� | �Թ��������Լ���������/mL | ��Һ������ɫ����ʱ��/min | |||
| 0.6 mol/L H 2C2O4��Һ | H2O | 0.2 mol/L KMnO4��Һ | 3 mol/L ϡ���� | |||
| 1 | 20 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 20 | 3.0 | m | 2.5 | n | 4.8 |
| 3 | 20 | 3.0 | 3.0 | 2.0 | 2.0 | t1 |
| 4 | 30 | 3.0 | 2.0 | 3.0 | 2.0 | t2 |
| ʵ���� | �¶�/�� | �Թ��������Լ���������/mL | �����Թ��м����������� | ��Һ������ɫ����ʱ��/min | |||
| 0.6 mol/L H 2C2O4��Һ | H2O | 0.2 mol/L KMnO4��Һ | 3 mol/L ϡ���� | ||||
| 5 | 20 | 3.0 | 2.0 | 3.0 | 2.0 | t3 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��3��11 | B��11��3 |
| C��1��4 | D��4��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A��ͼ��t1ʱ�ı�������������������¶Ȼ�������ѹǿ |
| B��ͼ�ڸ�����Ϊ18O2-����Ϊ16O2- |
| C��ͼ����AΪCaO����B����ΪMgO |
| D��ͼ���еġ�H1����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����⾫��ͭʱ���Դ�ͭ����������ͭ������ |
| B����������������������� |
| C��Na2O2��ˮ������Ӧʱ��Na2O2����������ˮ����ԭ�� |
| D�����г��ּ�������Ҫ�ǵ绯ѧ��ʴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��N2��H2��NH3�����ʵ����������ٸı� |
| B��c��N2����c��H2����c��NH3��=1��3��2 |
| C����λʱ��ÿ����1molN2��ͬʱ����2mol NH3 |
| D��N2��H2�����ʵ���֮����NH3��2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com