
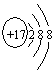 ;(3)O=C=O(1分);
;(3)O=C=O(1分);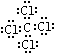 ;极性;(5)(1分)27
;极性;(5)(1分)27

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源:不详 题型:填空题
| 实验步骤 | 实验现象(与步骤未对应) |
| ① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
| 实验内容 | ① | ② | ③ | ④ |
| 实验现象(填A~D) | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 族 周期 | | | | |||||
| 1 | ① | | | | | | | |
| 2 | | | | | | ② | | |
| 3 | ③ | | | ④ | | ⑤ | ⑥ | |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题




查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.非金属性: P>S>Cl | B.碱性:NaOH>KOH>RbOH |
| C.气态氢化物稳定性:HF>HCl>HBr | D.酸性:H2SO4>HClO4>HBrO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
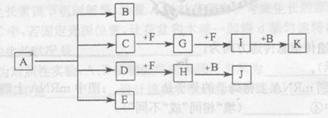
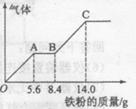
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.原子序数X<Y<W<Z | B.纯净的X与纯净的Z反应生成XZ3 |
| C.Z的最高正价为+6 | D.HW是热稳定性最强的氢化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com