
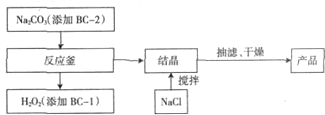
分析 (1)根据双氧水的不稳定性质分析,双氧水易分解,工业纯碱中常含有微量Fe3+,Fe3+为H2O2分解的催化剂;
(2)依据题干信息过碳酸钠的化学式2Na2CO3•3H2O2,可知过碳酸钠和过氧化氢之间在反应釜中发生的主要反应;根据同离子效应,常温结晶的过程中加入氯化钠、搅拌,钠离子浓度增大,抑制了过碳酸钠溶解;
(3)过碳酸钠可以看作Na2CO3和H2O2的混合物,过氧化氢分解生成氧气与水应与易燃或可燃物、还原剂等分开存放;过氧化氢具有氧化性能灼伤人的眼睛、皮肤,不慎溅入眼睛应用流动清水或生理盐水冲洗,并就医,不通风的仓库内会造成仓库中氧气含量升高,发生危险;
(4)过碳酸钠是一种很好的消毒剂,其消毒原理为具有强氧化性能使蛋白质变性;
(5)过碳酸钠可以看作Na2CO3和H2O2的混合物,过碳酸钠溶于水配成溶液,加入水量MnO2,使过氧化氢分解生成氧气与水,反应完全后溶液质量减轻0.264g为氧气的质量,利用化学方程式2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑过氧化氢的质量,根据[ω(活性氧)=$\frac{16n({H}_{2}{O}_{2})}{m(样品)}$×100%]求出活性氧的质量分数.
解答 解:(1)双氧水易分解,BC-1为稳定剂,加入BC-1能增强双氧水的稳定性,从而抑制其分解,工业纯碱中常含有微量Fe3+,Fe3+为H2O2分解的催化剂,加入BC-2可与Fe3+形成配合物,防止Fe3+催化H2O2的分解,
故答案为:增强H2O2的稳定性,防止其分解;防止Fe3+催化H2O2的分解;
(2)碳酸钠和双氧水反应生成过碳酸钙,反应方程式为:2Na2CO3+3H2O2=2Na2CO3•3H2O2,结晶过程中加入氯化钠、搅拌,可以增大溶液中钠离子浓度,能降低过碳酸钠的溶解度,有利于过碳酸钠析出,
故答案为:2Na2CO3+3H2O2=2Na2CO3•3H2O2;降低过碳酸钠的溶解度,有利于过碳酸钠的析出;
(3)过碳酸钠具有Na2CO3和H2O2的双重性质,则应具有不稳定性、碱性、强氧化性.
A.过碳酸钠可以看作Na2CO3和H2O2的混合物,具有强氧化性,应与易燃或可燃物、还原剂等分开存放,故A正确;
B.过碳酸钠具有氧化性,能灼伤人的眼睛、皮肤,使用时避免与眼睛、皮肤和衣服接触,故B正确;
C.过碳酸钠易分解生成氧气,储存于干燥洁净、不通风的仓库内,会造成仓库中氧气含量升高,发生危险,故C错误;
D.过碳酸钠具有氧化性,过碳酸钠不慎溅入眼睛应用流动清水或生理盐水冲洗,并就医,故D正确;
故答案为:C;
(4)A.乙醇能使蛋白质变性,但乙醇不具有强氧化性,与过碳酸钠的消毒原理不同,故A错误;
B.漂粉精主要成分为次氯酸钠,+1价的氯具有氧化性,与过碳酸钠的消毒原理相同,故B正确;
C.二氧化硫能消毒,但二氧化硫不具有强氧化性,与过碳酸钠的消毒原理不同,故C错误;
D.过氧化钠中-1价的氧具有氧化性,过氧化钠消毒与过碳酸钠的消毒原理相同,故D正确;
故答案为:BD;
(5)过碳酸钠可以看作Na2CO3和H2O2的混合物,过碳酸钠溶于水配成溶液,加入水量MnO2,使过氧化氢分解生成氧气与水,反应完全后溶液质量减轻0.264g为氧气的质量,
设样品中相当于含过氧化氢的质量为x
2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑
68 32
x 0.264g
x=$\frac{0.264g×68}{32}$=0.561g
则该样品中所含活性氧的质量分数[ω(活性氧)=$\frac{16n({H}_{2}{O}_{2})}{m(样品)}$×100%=$\frac{\frac{0.561g}{34g/mol}×16}{2g}$=13.2%,
故答案为:13.2%.
点评 本题考查过碳酸钠(2Na2CO3•3H2O2)的制备及其性质,依据题干信息将过碳酸钠看作Na2CO3和H2O2的混合物是解答关键,需要学生具备扎实的基础与综合运用知识分析问题、解决问题能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在离子化合物中,可能含共价键 | |
| B. | 在共价化合物中,可能含离子键 | |
| C. | 含共价键的化合物一定是共价化合物 | |
| D. | 含离子键的化合物不一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 只有干燥的布条褪色 | B. | 只有湿润的布条褪色 | ||
| C. | 两块布条均褪色 | D. | 两块布条均不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫代硫酸钠(Na2S2O3•5H2O)是一种脱氯剂,它易溶于水,难溶于乙醇,40~45℃熔化,48℃分解,由硫化钠和亚硫酸钠制备,涉及的反应原理为:
硫代硫酸钠(Na2S2O3•5H2O)是一种脱氯剂,它易溶于水,难溶于乙醇,40~45℃熔化,48℃分解,由硫化钠和亚硫酸钠制备,涉及的反应原理为: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Na2O2 溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3:4.与A相关的反应如下
烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3:4.与A相关的反应如下 ;
; ;
; 、
、 、
、 任意2种.(任写其中二种就可)
任意2种.(任写其中二种就可) )的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
)的合成路线流程图(无机试剂任选).合成路线流程图示例如下:

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com