
【题目】I.为粗略测定质量为Wg的电石中CaC2的质量分数,利用电石与饱和食盐水反应,实验装置如图所示:
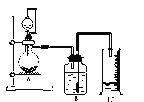
(1)烧瓶中发生反应的化学方程式是_____________
(2)产生的气体分子的中心原子的杂化轨道类型是____________
(3)实验测得量筒中水为VmL,该温度下气体摩尔体积为24.5 L/mol,则电石中CaC2质量分数为___________________
II.俄国化学家马尔柯夫尼柯夫因为提出碳碳双键的加成规则而闻名于世,该规则是指不对称的烯烃与HX或HCN加成时,氢总是加到含氢较多的双键碳原子上。
已知:![]()
以下是F的合成路线,请填写下列空白:
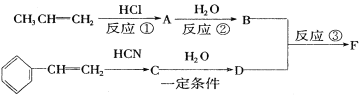
(1)写出C的结构简式______________
(2)B核磁共振氢谱共有__________________组氢
(3)写出③的化学方程式______________
(4)将F与含酚酞的NaOH溶液混合,加热一段时间后,可观察到的颜色变化是__________________
(5)若某有机物G是D的同系物,相对分子质量比D少14,则其分子式为:________;其同分异构体中含苯环且能使石蕊试液变红的物质共有______________种
【答案】CaC2+2H2O![]() Ca(OH) 2+C2H2↑ SP 64V×10-3/(24.5W)
Ca(OH) 2+C2H2↑ SP 64V×10-3/(24.5W) 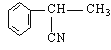 3
3 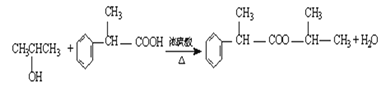 红色逐渐变浅 C8H8O2 4
红色逐渐变浅 C8H8O2 4
【解析】
I.结合实验室制取乙炔原理进行分析即可;II.由框图![]() 可知反应①发生了加成反应,根据马尔柯夫尼柯夫规则知生成A为CH3CHClCH3,反应②发生了取代反应,生成B为CH3CHOHCH3;由
可知反应①发生了加成反应,根据马尔柯夫尼柯夫规则知生成A为CH3CHClCH3,反应②发生了取代反应,生成B为CH3CHOHCH3;由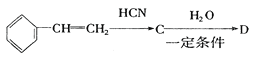 可知发生加成反应,根据马尔柯夫尼柯夫规则知生成C
可知发生加成反应,根据马尔柯夫尼柯夫规则知生成C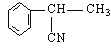 ,结合
,结合![]() ,可知D为
,可知D为![]() ;结合框图可知反应③为
;结合框图可知反应③为![]() 和CH3CHOHCH3发生了酯化反应。
和CH3CHOHCH3发生了酯化反应。
(1)烧瓶中是电石CaC2与饱和食盐水反应制取乙炔的反应,反应的化学方程式是CaC2+2H2O![]() Ca(OH) 2+C2H2↑;答案:CaC2+2H2O
Ca(OH) 2+C2H2↑;答案:CaC2+2H2O![]() Ca(OH) 2+C2H2↑;
Ca(OH) 2+C2H2↑;
(2)C2H2中心原子C有4个价电子,端基成2个,H一个单电子,另外一个C三个单电子,带入得(4-3-1)/2+2=2,所以C原子为sp杂化;答案:sp;
(3)由实验测得量筒中水为VmL,说明产生乙炔气体为VmL=10-3VL,该温度下气体摩尔体积为24.5 L/mol,乙炔的物质的量为:n=10-3VL /24.5 L/mol;再根据CaC2+2H2O![]() Ca(OH) 2+C2H2↑反应可知CaC2的质量为0.001VL /24.5 L/mol
Ca(OH) 2+C2H2↑反应可知CaC2的质量为0.001VL /24.5 L/mol![]() 64g/mol,则电石中CaC2质量分数为0.001VL /24.5 L/mol
64g/mol,则电石中CaC2质量分数为0.001VL /24.5 L/mol![]() 64g/mol /Wg
64g/mol /Wg![]() = 64V×10-3/(24.5W);答案:64V×10-3/(24.5W);
= 64V×10-3/(24.5W);答案:64V×10-3/(24.5W);
II (1)根据上述分析可知C的结构简式![]() ;答案
;答案![]() ;
;
(2)根据上述分析可知B的结构简式CH3CHOHCH3,核磁共振氢谱共有3组氢;答案:3;
(3)根据上述分析可知反应③为![]() 和CH3CHOHCH3发生的酯化反应,则③的化学方程式
和CH3CHOHCH3发生的酯化反应,则③的化学方程式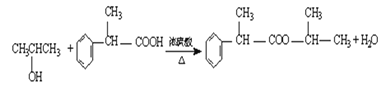 ;答案
;答案 ;
;
(4)由F的结构简式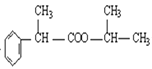 可知含有酯基,所以F能与NaOH溶液反应。加热一段时间后,含酚酞的NaOH红色溶液的颜色逐渐变浅;答案:红色逐渐变浅。
可知含有酯基,所以F能与NaOH溶液反应。加热一段时间后,含酚酞的NaOH红色溶液的颜色逐渐变浅;答案:红色逐渐变浅。
(5)由D为![]() ,分子式为C9H10O2;有机物G是D的同系物,且相对分子质量比D少14,则G的分子式为:C8H8O2;能使石蕊试液变红说明含有羧基,所以G的同分异构体有
,分子式为C9H10O2;有机物G是D的同系物,且相对分子质量比D少14,则G的分子式为:C8H8O2;能使石蕊试液变红说明含有羧基,所以G的同分异构体有![]() (3种)、
(3种)、![]() ,共4种;答案:4;
,共4种;答案:4;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,不正确的是( )

A.过程①中,生成CuS的反应为H2S+Cu2+=CuS↓+2H+
B.过程②中,Fe3+作氧化剂
C.转化图中化合价不变的元素只有铜和氯
D.回收S的总反应为2H2S+O2=2H2O+2S↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物。下列说法正确的是
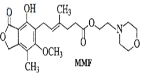
A. MMF能溶于水
B. 1mol MMF能与含3 mol NaOH的水溶液完全反应
C. MMF不存在顺反异构
D. 1mol MMF能与6 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
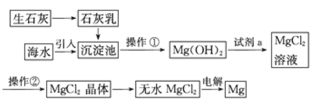
提示:①MgCl2晶体的化学式为MgCl2·6H2O。
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)操作①的名称是______,操作②的名称______、_____、过滤。
(2)试剂a的名称是_____。
(3)用氯化镁电解生产金属镁的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图。常温下,下列各点所对应溶液中微粒物质的量浓度关系正确的是( )

A.a点:c(N2O22-)+c(HN2O2-)-c(Na+)=9.9×10-7mol·L-1
B.b点:c(Na+)>c(N2O22-)+c(HN2O2-)+c(H2N2O2)
C.c点:c(Na+)>c(HN2O2-)>c(N2O22-)>c(H2N2O2)
D.d点:2c(H2N2O2)+c(HN2O2-)+c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】潮湿环境、Cl-、溶解氧是造成青铜器锈蚀的主要环境因素,腐蚀严重的青铜器表面大多存在起催化作用的多孔催化层。图为青铜器发生电化学腐蚀的原理示意图,下列说法正确的是( )

A.腐蚀过程中,青铜基体是正极
B.若有64gCu腐蚀,理论上耗氧体积为22.4L(标准状况)
C.多孔催化层的形成加速了青铜器的腐蚀速率,是因为改变了反应的焓变
D.环境中的Cl-、正负极产物作用生成多孔粉状锈,其离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com