
| A、达到平衡时,正反应速率等于逆反应速率 |
| B、增大氢气的浓度可增大反应速率 |
| C、在上述条件下,氢气能全部转化为碘化氢 |
| D、达到平衡时,体系中各物质的质量分数不再改变 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙酸乙酯中少量乙酸:加入饱和苏打溶液,振荡、静置分层后分液 |
| B、除去苯中少量苯酚:加入溴水,振荡后过滤 |
| C、除去SO2中的少量CO2:通过澄清石灰水 |
| D、提取溶解在水中的少量溴:加入苯,振荡、静置分层后,分液后取有机层进行蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、仅有① | B、仅有①② |
| C、仅有①③ | D、全都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 9 |
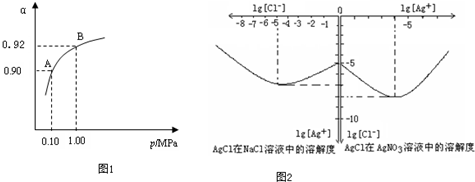
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 |
| B、电解精炼铜时,阳极泥中常含有金属金、银、锌等 |
| C、可充电电池放电时,化学能转变为电能 |
| D、铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
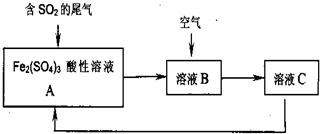
| A、溶液B中发生的反应为:2SO2+O2→2SO3 |
| B、由反应过程可推知氧化性:O2>Fe3+>SO42- |
| C、溶液的pH:A>B>C |
| D、A与C溶液成分相同,但浓度之比不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com