
����Ŀ��ij�о���ѧϰС�����ʵ��̽�����Ƚ��������ʣ�����Ƭ����������Ĥ��Ͷ��Ũ�Ȼ�ͭ��Һ�У�������ܿ����һ�㺣��״����ɫ���ʣ���������Ƭ�ϲ����������ݣ���������֪��Һ�¶�Ѹ���������ռ����壬��������п�ȼ�ԣ�����ͬ������ƬͶ��ͬŨ�ȵ�����ͭ��Һ�У��ڶ�ʱ������Ƭ�����Ա仯��
��1�������Ȼ�ͭ��Һ��Ѹ�ٷ�Ӧ������ͬŨ�ȵ�����ͭ��Һ�ڶ�ʱ���ڲ���Ӧ��ԭ�������________��
A���Ȼ�ͭ��Һ���Ա�ͬŨ�ȵ�����ͭ��Һ����ǿ
B������ͭˮ����������ʹ���ۻ�
C�����������ƻ����������污Ĥ������������Ӳ���
D�������Ȼ�������ˮ��������������������ˮ
�����һ����ʵ����֤���ѡ��________��
��2����Ƭ������ֵİ���ɫ���ʵĹ����з��������ӷ�Ӧ����ʽ��________�� �����ӷ���ʽ���Ͳ������ݵ�ԭ��________��
��3���ų���������________������й����ʵ�Ũ�ȡ��������Ƿ��е绯ѧ���õȷ�����ʼ�β�����������ʲ��ϼӿ��ԭ����________����д��һ�㼴�ɣ�
��4��ijͬѧͨ��һ����ʵ�������Ҳ��ʹ��Ƭ������ͭ��Һ��Ӧ�ӿ죬����ȡ�Ĵ�ʩ������________��
A����ɰֽ��ȥ��Ƭ���������Ĥ��Ͷ������ͭ��Һ��
B������ƬͶ��������������Һ��һ��ʱ���ȡ��ϴ�ӣ���Ͷ������ͭ��Һ��
C��������ͭ��Һ�еμ�����������Һ����Ͷ����Ƭ
D������Ƭ�����ϼ�öͭ����Ͷ��ͬŨ�ȵ�����ͭ��Һ��
��5����ȥ����������Ƭ��ͭƬΪ�缫����X�������Һ�й���ԭ��أ��б����£�
ѡ�� | ���缫 | ����� | ������Ӧ | ������Ӧ |
A | ���� | NaOH | Al��3e��=Al3+ | 2H2O+2e��=2OH��+H2�� |
B | ���� | ϡ���� | 2Al��6e��=2Al3+ | 6H++6e��=3H2�� |
C | ���� | Ũ���� | Cu��2e����=Cu2+ | 2NO3��+4H+��4e��=2NO2��+2H2O |
D | ���� | ϡ���� | Cu��2e��=Cu2+ | 2NO3��+8H+=2NO��+4H2O+6e�� |
������ȷ����________���ɴ���֪���������缫�����뱾��������أ�������_________�йأ�
���𰸡� C ������ͭ��Һ�м�����Ƭ�������������ټ����Ȼ��ƣ�ע�⣺���ܼ������ᣩ������Ӧ���Լӿ��ˣ�˵�������ƶ���ȷ Al3++3H2O![]() Al��OH��3+3H+ Cu2++2H2O
Al��OH��3+3H+ Cu2++2H2O![]() Cu��OH��2+2H+��2Al+6H+=2Al3++3H2�� ���� ���ŷ�Ӧ��������������Ũ������ˮ��̶�����������H+��÷�Ӧ���ȣ������¶ȷ�Ӧ�ӿ��ͭ��������ԭ��أ��ӿ���ʧ���ӣ� ABD B ����ʵ�����
Cu��OH��2+2H+��2Al+6H+=2Al3++3H2�� ���� ���ŷ�Ӧ��������������Ũ������ˮ��̶�����������H+��÷�Ӧ���ȣ������¶ȷ�Ӧ�ӿ��ͭ��������ԭ��أ��ӿ���ʧ���ӣ� ABD B ����ʵ�����
��������
(1)�������ı�����һ�����ܵ������ﱡĤ���Ȼ����������������ӵIJ�ͬ�����������ƻ����������污Ĥ������������Ӳ��ܣ���ѡC��������ͭ��Һ�м�����Ƭ���������������ټ����Ȼ���(ע�������ܼ�������)������Ӧ���Լӿ�����˵�������ƶ���ȷ��
(2)����ͭ�ʰ���ɫ�����������û�ͭ���еĽ���ͭ����2Al+ 3Cu2+==3Cu +2Al3+ ���Ȼ�ͭ������ͭ����ǿ����������ˮ��������,�������ܺ��ᷴӦ����������Al3++3H2O![]() Al��OH��3+3H+ ��Cu2++2H2O
Al��OH��3+3H+ ��Cu2++2H2O![]() Cu��OH��2+2H+��2Al+6H+=2Al3++3H2����
Cu��OH��2+2H+��2Al+6H+=2Al3++3H2����
(3)�������ܺ��ᷴӦ�����������¶ȡ�Ũ�ȡ�ԭ���ԭ������ʹ��ѧ��Ӧ���ʼӿ�����ʼ�β�����������ʲ��ϼӿ��ԭ��������ijһ���������صĽ�������ŷ�Ӧ��������������Ũ������(��ˮ��̶���������������H+��÷�Ӧ�����������¶ȷ�Ӧ�ӿ��ͭ��������ԭ������ӿ���ʧ����)��
(4)A����ɰֽ��ȥ��Ƭ���������Ĥ����Ͷ������ͭ��Һ�����γ���ͭԭ������ܼ��ٽ����ĸ�ʴ����A��ȷ��B���������ܺ�ǿ�Ӧ��Ȼ�����ƬͶ��Ͷ������ͭ��Һ�����γ���ͭԭ������ܼ��ٽ����ĸ�ʴ����B��ȷ��C������ͭ���������Ʒ������ֽⷴӦ����������ͭ����������������Ͷ����Ƭ����Ӧ����C������D������Ƭ�����ϼ�öͭ����Ͷ��ͬŨ�ȵ�����ͭ��Һ�������γ�ͭ����������ͭԭ���,���������������ӿ췴Ӧ���ʣ��� D��ȷ����ѡABD��
(5)��Ƭ��ͭƬΪ�缫���������ҺΪ����ʱ���������������������������������ʱ�����ǽ����������������������Ũ����ʱ�������������ۻ�������ͭ�����������ÿ��Է���������ԭ��Ӧ��ʧ���ӵĵ���ԭ����˭��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��Ƽ�����ͼ��ʾװ�D�����ּг�װ�ü���ȥ������ʵ��̽����
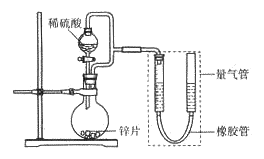
(1)������װ��̽��Ӱ�컯ѧ��Ӧ���ʵ����ء�������9.0 mL����Ϊ��ʱ�յ㣬���Ϊt1>t2��
��� | V(H2SO4��/mL | C(H2SO4)/mol��L-1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 4 | t2 |
�ٱȽ�ʵ��I�͢���Եó���ʵ�������_______________��
������пƬ���ɺ����ʵĴ�пƬ����������ʹ��������һ�£�����õķ�Ӧ���ʾ���������ʵ���Ӧ�����ݡ���пƬ���������ʿ�����_________������ţ���
A.�������� B.�� C.ͭ D.ʯī
(2)������װ����֤�����ڳ�ʪ�����лᷢ��������ʴ��
��Բ����ƿ�е��Լ���ѡ��________������ţ���
A.ϡHCl B .NaCl��Һ C.�Ҵ� D.NaOH��Һ
����֤�������ڳ�ʪ�����лᷢ��������ʴ��������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W���ֶ�����Ԫ����Ԫ�����ڱ��е�λ�ù�ϵ��ͼ:
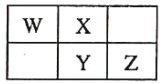
I.��YԪ��ԭ�ӵ������������ǵ��Ӳ�����2����
(1)Z�����ڱ��е�λ����___��
(2)д��ͭ��W������������ˮ�����ϡ��Һ��Ӧ�����ӷ���ʽ:__________��
(3)Z����������ˮ�����Ũ��Һ���ȶ�,���ȿɷֽ�,����֮һ�ǻ���ɫ����,�ҵ���28mol���ӷ���ת��ʱ,������9mol����,д���÷�Ӧ�Ļ�ѧ����ʽ:____________��
II.��X��Y�ĺ��������֮��Ϊ22��
(4)X����̬�⻯��ĵ���ʽΪ______�������⻯��ͨ��������Һ��,ǡ�÷�Ӧʱ������Һ������Ũ�ȴ�С��˳��Ϊ____________��
(5)W�ĵ�����Z������������ˮ�����Ũ��Һ��Ӧ,������ת��0.4molʱ����������������_________(��״��)��
(6)�����ܱȽ�ZԪ������Ԫ�طǽ�����ǿ������_________��
A.����ͨ��������Һ��,��Һ�����
B.������ǿ��,������������
C.�Ȼ���������ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CH3CHO(������ˮ���е�Ϊ20.8 ��)��CH3COOH(������ˮ���е�Ϊ117.9 ��)���������ʷ�����
A. ����
B. ����Na2CO3��Һ��ͨ����ȡ�ķ�������
C. �����ռ���Һ֮���������ȩ���ټ���Ũ���ᣬ���������
D. ��Na��Ӧ����з���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ģ��绯ѧ��Ӧ��װ��ͼ���й�������ȷ����
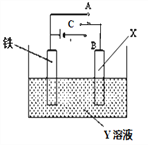
A. XΪ̼����YΪNaCl��Һ������C����A������������ ��������
B. XΪͭ����YΪCuSO4��Һ������C����B����������������С����Һ��Cu2+Ũ��Ҳ��С
C. XΪ̼����YΪNaCl��Һ������C����B���������ɸ���������Ƭ��������Ƭͨ����Һ����̼���������������
D. XΪпƬ��YΪNaCl��Һ������C����A������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���õؿ��й�Ԫ�������Ķ��ֲ�Ʒ���ִ��߿Ƽ���ռ��Ҫλ�ã������ѧ���ִ�������������Ҫ���ã����磺
��1�����ά����Ҫ�ɷ���________
��2��ĿǰӦ������̫���ܵ�صĹ��ת��������________
��3��������Ŀ�ĵ�������һ�����ʶԲ������л�ѧ��ʴ���Ƴɵģ��÷�Ӧ�Ļ�ѧ����ʽΪ________
��4����ҵ����ȡ�ֹ�����ʯӢ�ͽ�̿�ڸ��µ�¯�з�Ӧ�Ƶã��÷�Ӧ���������뻹ԭ����������Ϊ��________����ʯӢ�ͽ�̿�ڸ��µ�¯�з�ӦҲ�����Ƶý��ɰ��SiC����������CO���壬�÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ________
��5����������������������������������Һ�У���Ӧ�����ӷ���ʽ�ֱ���________��________
��6������������0.1mol�����ƣ�����������С����ˮ�У���ȫ��Ӧ������ˮ���ռ�����״������������________������ĸ��ţ���
a������1.12L b������1.12L c����1.12L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����еİ��ϳ�����Һ��ȼ�Ϻϳ����Ʊ����ո������ܺĸߣ��п�Ժ������ѧ�����о�������ڻ�ϵ�����Ĥ��Ӧ����һ��ͬʱ�Ʊ����ϳ�����Һ��ȼ�Ϻϳ����ĸ����ȡ���о���չ���乤��ԭ����ͼ��ʾ������˵���������

A. ĤI���൱��ԭ��ص�����
B. O2��H2O��������ԭ��Ӧ
C. ĤII����ķ�ӦΪ:CH4+O2--2e-=2H2+CO
D. ĤII������CH4��ĤI������H2�����ʵ���֮��Ϊ1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£�1mol �κ��������Ϊ22.4L����ô�ڱ�״���£�700L NH3 �����ʵ���Ϊ________mol��ȫ���ܽ���1Lˮ�У�������Һ����������Ϊ________������ð�ˮ���ܶ�Ϊ0.85gcm��3 �� ��ˮ�����Ϊ��________L�����ʵ���Ũ��Ϊ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������β������װ��������ڴ��������������ͷŵĹ�����ͼ��ʾ������˵����ȷ���ǣ� ��
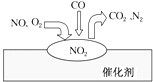
A. NO�Ǹù��̵��м���� B. NO��O2�����ڴ���������ܷ�Ӧ
C. ����β������Ҫ��Ⱦ�ɷְ���CO2��N2 D. ����β������Ҫ��Ⱦ����CO��NO
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com