
| A、加入Ba(NO3)2溶液生成白色沉淀,加入稀盐酸后沉淀不消失,则原溶液中一定含有SO42- |
| B、通入氯气后,溶液变黄色,加入淀粉溶液后变蓝,则原溶液中一定有I- |
| C、加入碳酸钠溶液有白色沉淀生成,再加入盐酸,沉淀消失,则原溶液中一定含有Ba2+ |
| D、加入氢氧化钠溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则原溶液中一定有NH4+ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
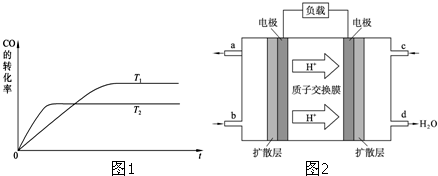
查看答案和解析>>
科目:高中化学 来源: 题型:
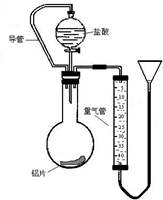 (1)在探究铝和盐酸反应的实验现象是:“向铝片滴加盐酸,开始铝片表面出现少量气泡,而且气泡越来越多,甚至于使酸液‘沸腾’起来.”请解释上述现象.
(1)在探究铝和盐酸反应的实验现象是:“向铝片滴加盐酸,开始铝片表面出现少量气泡,而且气泡越来越多,甚至于使酸液‘沸腾’起来.”请解释上述现象.查看答案和解析>>
科目:高中化学 来源: 题型:
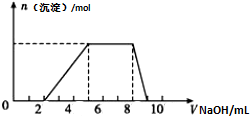 某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )| A、原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+ |
| B、反应最后形成的溶液中的溶质含AlCl3 |
| C、原溶液中Al3+与NH4+的物质的量之比1:3 |
| D、原溶液中含有的阴离子是AlO2-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com