

分析 过氧化钠与水反应生成氢氧化钠和氧气,生成的气体为氧气,氢氧化钠与氯化铁反应生成氢氧化铁,为红褐色沉淀,氢氧化钠与氧化铝反应生成偏铝酸钠,以此解答该题.
解答 解:过氧化钠与水反应生成氢氧化钠和氧气,生成的气体为氧气,氢氧化钠与氯化铁反应生成氢氧化铁,为红褐色沉淀,氢氧化钠与氧化铝反应生成偏铝酸钠,
(1)由以上分析可知A为O2,C为氢氧化铁,故答案为:O2;氢氧化铁;
(2)反应生成偏铝酸钠和氯化钠,二者都溶于水,溶液中含有的阴离子为AlO2-.Cl-,故答案为:AlO2-.Cl-;
(3)过氧化钠和水反应的方程式为2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑.
点评 本题以“无机框图题”的形式考查元素单质及其化合物的性质,涉及常用化学用语、化学方程式的书写等,为高频考点,难度不大,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 定容时不慎使液面超过刻度 | |
| B. | 容量瓶中有少量的水,配制前未进行干燥处理 | |
| C. | 未将洗涤玻璃棒和烧杯的洗涤液转入容量瓶中 | |
| D. | 定容时,俯视看刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| V(Cl2)(标况,L) | 2.8 | 5.6 | 11.2 |
| n(Cl-) mol | 1.5 | 1.75 | 2.25 |
| n(Br-) mol | 1.5 | 1.4 | 0.9 |
| n(I-)mol | a | 0 | 0 |
| A. | 当通入氯气的体积为2.8L时,溶液中发生的离子反应式只有:Cl2+2I-═2Cl-+I2 | |
| B. | 表中a的值为0.5 | |
| C. | 原溶液中Cl-、Br-、I-物质的量之比为15:15:8 | |
| D. | 原溶液中I-的物质的量浓度为0.25mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7g金属铝变成铝离子时失去的电子数目为0.1NA(提示:M(Al)=27g/mol) | |
| B. | 17g氨气所含的电子数目为10NA(提示:M(NH3)=17g/mol) | |
| C. | 2g氢气所含原子数目为NA(提示:M(H2)=2g/mol) | |
| D. | 常温常压下,11.2L氮气所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
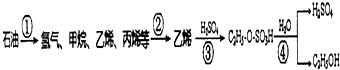 以石油为原料制备乙醇的转化流程图如下所示:跟如图流程图相关的说法中正确的是( )
以石油为原料制备乙醇的转化流程图如下所示:跟如图流程图相关的说法中正确的是( )| A. | 流程图①中产物均为烃类,产物均为可燃性气体 | |
| B. | 流程图①中需减压分馏,②中需分馏分离出乙烯 | |
| C. | 流程图③中发生加成反应,④中发生取代反应 | |
| D. | 乙醇、硫酸都能够使蛋白质变性,都可用于皮肤消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加硫铁矿石的投入量 | B. | 增加炉的高度 | ||
| C. | 降低温度 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲一定是共价化合物,乙一定是离子化合物 | |
| B. | 甲一定是共价化合物,乙可能是共价化合物 | |
| C. | 甲可能是离子化合物,乙可能是共价化合物 | |
| D. | 甲一定是离子化合物,乙可能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 有机物 | 甲醇(CH3OH) | 丙烯(CH3CH=CH2) | 一氟甲烷(CH3F) |
| 相对分子质量 | 32 | 42 | 34 |
| 沸点/℃ | 64.7 | -47.4 | -78.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com