
| A. | 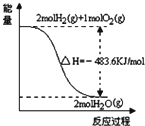 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为-241.8kJ•mol-1 | |
| B. | 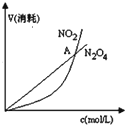 表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 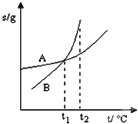 表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 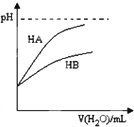 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化.则NaA溶液的pH小于等物质的量浓度的NaB溶液的pH |
分析 A、燃烧热是1mol可燃物完全燃烧生产稳定化合物释放的能量;
B、反应物和生成物的浓度不可能都变大;
C、t1℃时AB浓度相同,升温时饱和状态变化,无溶质析出,浓度不变;
D、酸的酸性越强,pH的变化越大;
解答 解:A、图象中2mol氢气完全燃烧生成的是水蒸气时放热241.8kJ,不是氢气的燃烧热,故A错误;
B、反应2NO2?N2O4(g)中,反应物和生成物的浓度不可能都变大,故B错误;
C、t1℃时AB浓度相同,升温时饱和状态变化,无溶质析出,浓度不变,故C错误;
D、随加水量的增多,HA的pH变化大,说明HA的酸性强于HB,据越弱越水解的原则,NaB水解程度大,故NaA溶液的碱性弱于NaB溶液,pH小,故D正确;
故选:D.
点评 本题依据图象分析问题,解决问题,考查学生的观察能力,并考查了基础知识,好题.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中一定不含有离子键,离子化合物中可能含有共价键 | |
| B. | 充电电池的化学反应原理是氧化还原反应 | |
| C. | 一定条件下,将1 mol N2与3 mol H2充入密闭容器中充分反应可生成2 mol NH3 | |
| D. | 质子数相同、电子数也相同的两种微粒,不可能是一种分子和一种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | ||
| C. | 2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+) | D. | c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾 | B. | 氯化铁 | C. | 浓溴水 | D. | 水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
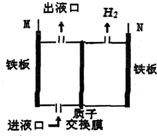 如图所示,某工厂采用电解法处理含铬(Cr2O72-)酸性废水,其中,耐酸电解槽以铁板作阴、阳极,电解后,溶液中的Cr2O72-全部变为Cr3+,下列说法不正确的是( )
如图所示,某工厂采用电解法处理含铬(Cr2O72-)酸性废水,其中,耐酸电解槽以铁板作阴、阳极,电解后,溶液中的Cr2O72-全部变为Cr3+,下列说法不正确的是( )| A. | M与电源的正极相连 | B. | 出液口排出的溶液中还含有Fe3+ | ||
| C. | N极电极反应为2H++2e-═H2↑ | D. | 阴极区附近溶液pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速度一定大于逆反应速度 | B. | 反应物的转化率一定增大 | ||
| C. | 正反应速率一定增大 | D. | 生成物的质量分数一定增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇燃烧 | B. | 乙烯使溴的四氯化碳溶液褪色 | ||
| C. | 乙烯使酸性高锰酸钾溶液褪色 | D. | 苯和液溴反应制备溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com