
分析 (1)溶液中的离子积Kw=C(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-12;
(2)该NaOH溶液中NaOH的物质的量浓度为C(NaOH)=c(OH-)=10-bmol/L;依据溶液中的离子积Kw=C(H+)×c(OH-)=10-12;该NaOH溶液中由水电离出的c(OH-)为10-a;
(3)给该NaOH溶液加热,促进水的电离,溶液中存在离子积常数,离子积常数增大,溶液中氢氧根离子浓度是碱的氢氧根离子浓度不变,氢离子浓度增大,所以溶液PH减小;
(4)根据酸和碱的物质的量相等计算.
解答 解:(1)溶液中的离子积Kw=C(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-12;故答案为:10-12mol2/L2;
(2)该NaOH溶液中NaOH的物质的量浓度为C(NaOH)=c(OH-)=10-bmol/L;依据溶液中的离子积Kw=C(H+)×c(OH-)=10-12;该NaOH溶液中由水电离出的c(OH-)为10-a;
故答案为:10-bmol/L;10-amol/L;
(3)给该NaOH溶液加热,促进水的电离,溶液中存在离子积常数,离子积常数增大,溶液中氢氧根离子浓度是碱的氢氧根离子浓度不变,氢离子浓度增大,所以溶液PH减小;
故答案为:变小;
(4)完全中和时,酸和碱的物质的量相等,a=8,则氢氧化钠的物质的量浓度为0.0001mol/L,中和该NaOH溶液500mL,需pH=2的盐酸溶液体积=$\frac{0.0001mol/L×0.5L}{0.01mol/L}$=5mL,
故答案为:5mL.
点评 本题考查了水溶液中的离子积常数应用,溶液PH计算应用,关键是离子积常数随温度变化,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | Al、Fe、Cu三者的单质放置在空气中均只生成氧化物 | |
| C. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 | |
| D. | C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 某酸性溶液中,HCO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、Na+可大量共存 | |
| B. | NA表示阿伏加德罗常数,则常温常压下,3.0g乙烷中含有的碳氢键数为0.6NA | |
| C. | 实验室中,常用玻璃瓶盛放氢氟酸 | |
| D. | 用饱和NaHCO3溶液可除去CO2中的HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
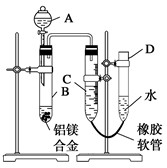 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4Al(S04)2溶液中滴加过量Ba(OH)2溶液:2Ba2++40H-+2S042-+Al3+=2BaS04↓+2H20+Al02- | |
| B. | 向NaHS04溶液中滴Ba(OH)2溶液至S042-完全沉淀:2 H++S042-+Ba2++20H-=BaS04↓+2H20 | |
| C. | 向0.1mol.L-l、pH=l的NaHA溶液中加入NaOH溶液:HA-十OH-=A2-+H20 | |
| D. | 向1L lmol.L-1的FeBr2溶液中通等物质的量Cl2:2Cl2+2Fe2++2Br-=4Cl-十2Fe3++Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com