
分析 (1)FeSO4溶液变质混合铁离子,应加Fe反应防止变质;
(2)FeSO4溶液中滴加NaOH溶液,FeSO4和NaOH发生复分解反应生成氢Fe(OH)2,Fe(OH)2不稳定,易被氧气氧化生成Fe(OH)3;
解答 解:(1)FeSO4溶液变质混合铁离子,应加Fe反应防止变质,则发生的离子反应为2Fe3++Fe═3Fe2+,故答案为:2Fe3++Fe═3Fe2+;
(2)FeSO4溶液中滴加NaOH溶液,FeSO4和NaOH发生复分解反应生成白色沉淀Fe(OH)2,Fe(OH)2不稳定,易被氧气氧化生成红褐色沉淀Fe(OH)3,所以看到的现象是:先生成白色沉淀,白色沉淀立即转化为灰绿色,最终转化为红褐色,反应方程式分别为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:白;红褐;
点评 本题考查了硫酸亚铁、氢氧化亚铁的制取,注意氢氧化亚铁不稳定易被氧气,硫酸亚铁防止氧化的措施,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅的分子式:SiO2 | B. | 甲基的电子式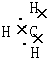 | ||
| C. | 水分子的结构式:H-O-H | D. | Na2O2中阴,阳离子数之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa与CH3COOH混合溶液呈中性,则溶液中有c(CH3COO-)═c (Na+) | |
| B. | NaHCO3溶液中有:c (H+)+c (H2CO3)═c (OH-)+c (CO32-) | |
| C. | 物质的量浓度均为0.1 mol/L的Na2CO3和NaHCO3的混合溶液中有:c (Na+)>c (HCO3-)>c (CO32-)>c (OH-)>c (H+) | |
| D. | 常温下,p H为2的某酸HA与pH为12的某碱BOH等体积混合溶液呈酸性,则HA为强酸BOH为弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸、纯碱、胆矾、铜 | B. | 硫酸、烧碱、小苏打、纯碱 | ||
| C. | 盐酸、乙醇、氯化钠、碘酒 | D. | 醋酸、漂白粉、石灰石、二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯(苯酚):加浓溴水,过滤 | |
| B. | 淀粉溶液(NaCl):半透膜,渗析 | |
| C. | 溴乙烷(乙醇):加蒸馏水,分液 | |
| D. | 乙酸乙酯(乙醇):加饱和碳酸钠溶液,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
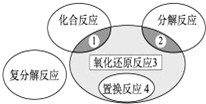
| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
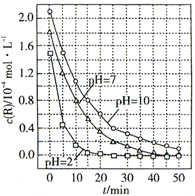
| A. | 溶液酸性越强,R的降解速率越小 | |
| B. | R的起始浓度越小,降解速率越大 | |
| C. | 在0~50 min之间,pH=2和pH=7时R的降解百分率相等 | |
| D. | 在20~25 min之间,pH=10时R的平均降解速率为0.02 mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com