
| A、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | ||||
B、NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-
| ||||
| C、漂白粉溶液中通入足量的SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | ||||
| D、明矾溶液与氢氧化钡溶液反应,使 SO2-恰好完全沉淀:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,向0.01 mol/L NHHSO溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B、0.1 mol/L NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| C、Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
| D、25℃时,浓度均为0.1 mol/L的CH3COOH、CH3COONa混合溶液的pH=4.75:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Mg( HC03)2溶液中加入过量的NaOH溶液:Mg2++2 HC03-+20H-═MgC03↓+C032-+2H20 |
| B、向NH4 Al( S04)2溶液中滴人Ba( OH)2溶液使SO42-反应完全:2Ba2++40H-十Al3++2 SO42-═2BaS04↓+Al02-+2H20 |
| C、足够的C02通入饱和碳酸钠溶液中:C02+CO32-+H20=2 HC03- |
| D、向Fe( N03)2溶液中加入稀盐酸:3Fe2++4H++N03-═3Fe3++NO↑+2H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-的水解方程式可表示为:HCO3-+H2O?H3O++CO32- |
| B、向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)3Fe+8 H++2NO3-=3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、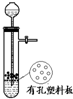 用于Cu和浓H2SO4反应制取少量的SO2气体 |
B、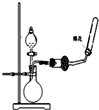 用于制备并收集NH3 |
C、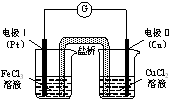 可形成原电池并获得稳定电流 |
D、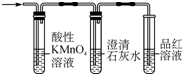 用于检验制得的乙烯中是否混有SO2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①②⑤⑥ |
| C、③⑤⑥⑦ | D、①③④⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com