
| A. | 酸雨易导致土壤胶粒吸附H+使土壤酸化,影响铵态氮肥和钾肥的有效利用 | |
| B. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| C. | 高纯度的单晶硅用于制造登月车的光电池和光导纤维 | |
| D. | 铝及其合金是电气、工业、家庭广泛使用的材料,通常用电解氯化铝的方法制取铝 |
分析 A.土壤胶体带负电荷能吸附阳离子;
B.汽油中不含有N元素;
C.晶体硅不能制造光导纤维,光导纤维的材料是二氧化硅;
D.氯化铝是共价化合物熔融时不导电.
解答 解:A.土壤胶体带负电荷能吸附阳离子,当土壤胶粒吸附H+使土壤酸化,就不能吸附铵根离子和钾离子,所以铵态氮肥和钾肥容易流失,故A正确;
B.汽油中不含有N元素,汽车尾气污染物中含有氮的氧化物,是空气中的氮气和氧气在高温下反应生成的,故B错误;
C.晶体硅是半导体材料,可用于制造光电池,晶体硅不能制造光导纤维,光导纤维的材料是二氧化硅,故C错误;
D.氯化铝是共价化合物熔融时不导电,所以不能用电解氯化铝的方法制备金属铝,应该电解熔融的氧化铝,故D错误.
故选A.
点评 本题考查胶体的性质、汽油的成分、硅及其化合物的性质和用途、金属的冶炼,题目难度不大,注意基础知识的理解掌握,侧重于考查学生对基础知识的应用能力.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 | |
| B. | 图乙表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件一定是缩小容器体积 | |
| C. | 图丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数以ω(B)>ω(A) | |
| D. | 图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁能与酸反应,可用于制作红色涂料 | |
| B. | SO2具有漂白性,可在白葡萄酒中微量添加 | |
| C. | 钠钾合金硬度小,可用作原子反应堆的导热剂 | |
| D. | 酒精能使蛋白质变性,可在医疗上用来杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Na+、K+、Br-、CO32- | |
| B. | 0.1 mol/LCa(ClO)2溶液中:Fe2+、A13+、I-、SO42- | |
| C. | 0.1 mol/L Fe2(SO4)3溶液中:NH4+、Cu2+、NO3-、SO42- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13 mol/L的溶液中:Ca2+、NH4+、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能与氧气反应 | B. | 储存巨大能量 | ||
| C. | 是氢的一种同素异形体 | D. | 内部存在自由移动的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
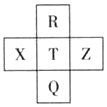 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | T的单质在化学反应中只表现氧化性 | |
| B. | R与Q的电子数相差16 | |
| C. | T形成的含氧酸的酸性一定比X形成的含氧酸强 | |
| D. | 在这五种元素中Z的化学性质最稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75.77%表示35Cl的质量分数 | |
| B. | 24.23%表示35Cl在自然界所占的原子个数百分比 | |
| C. | 35.453表示氯元素的相对原子质量 | |
| D. | 36.966表示37Cl的质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的简单气态氢化物的热稳定性比Y的强 | |
| B. | 原子半径:r(W)>r(Q)>r(Z)>r(X) | |
| C. | 由X、Y、Z三种元素组成的化合物可以是酸、碱或盐 | |
| D. | Q的最高于氧化物对应的水化物可以溶于浓的YX4W溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.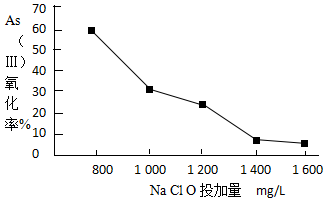
| pH | <2 | 2~7 | 7~11 | 11~14 |
| 存在形式 | H3AsO4 | H2AsO3- | HAsO42- | HAsO42-、AsO43- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com