
分析 CO2溶于水中,大部分形成CO2•6H2O,只有一小部分形成H2CO3,经实测K=c(CO2•6H2O)/c(H2CO3)=600,设c(H2CO3)为x,则c(CO2•6H2O)=600x,在常温常压下,CO2饱和溶液的浓度约为0.04mo1•L-1,依据碳元素守恒得到,x+600x=0.04,得到x=6.65×10-5mol/L,结合H2CO3?HCO3-+H+ 的平衡常数表达式计算得到K.
解答 解:CO2溶于水中,大部分形成CO2•6H2O,只有一小部分形成H2CO3,经实测K=c(CO2•6H2O)/c(H2CO3)=600,设c(H2CO3)为x,则c(CO2•6H2O)=600x,在常温常压下,CO2饱和溶液的浓度约为0.04mo1•L-1,依据碳元素守恒得到,x+600x=0.04,得到x=6.65×10-5mol/L,pH约为4,忽略HCO3-?CO32-+H+ 的电离,则H2CO3?HCO3-+H+ 的平衡浓度为:c(H+)=c(HCO3-)=10-4mol/L,平衡常数表达式计算得到Ka1=$\frac{1{0}^{-4}×1{0}^{-4}}{6.65×1{0}^{-5}}$=1.5×10-4,
故答案为:1.5×10-4;
点评 本题考查了弱电解质电离平衡的分析,饱和溶液中元素守恒的应用,注意平衡常数的计算方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NA个氧气分子的体积约为11.2L | |
| B. | 1.8g的NH4+离子中含有的电子数为10NA | |
| C. | 标准状况下,2.24 L氢气和氧气以任意比组成的混合气体,所含的原子数约为0.2NA | |
| D. | 7.8g过氧化钠固体中含有的阴、阳离子的总数约为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA | |
| B. | 0.1 mol•L-1的AlCl3溶液与足量NaOH溶液反应所得产物中含AlO2-为0.1NA | |
| C. | 足量Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA | |
| D. | 常温常压下,1.6g甲烷中含有的碳原子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
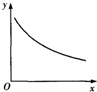 在某密闭容器中充入H2S和O2,发生反应:2H2S(g)+O2(g)?S2(g)+2H2O(g)△H<0,达到平衡后,若仅改变横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势符合图象的是( )
在某密闭容器中充入H2S和O2,发生反应:2H2S(g)+O2(g)?S2(g)+2H2O(g)△H<0,达到平衡后,若仅改变横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势符合图象的是( )| 选项 | x | y |
| A | 温度 | 混合气体平均相对分子质量 |
| B | 压强 | S2气体体积分数 |
| C | 容器体积 | H2S浓度 |
| D | O2浓度 | 平常常数逆反应速率 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;X元素基态原子的电子排布式为1s22s22p63s23p5.
;X元素基态原子的电子排布式为1s22s22p63s23p5.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 可能存在大量Ba2+ | B. | 溶液中Na+物质的量小于0.12mol | ||
| C. | 可能存在Cl- | D. | 溶液中c(Na+)≥0.6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;△H1>△H2 | |
| B. | C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,则可判定金刚石比石墨稳定 | |
| C. | 中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测出的中和热数值偏小 | |
| D. | 已知反应:①101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则C的燃烧热为110.5kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液中:S2-、SO42-、SO32-、Na+ | |
| B. | 由水电离出来的c(H+)=10-12mol/L的溶液中:Na+、HCO3-、SO42-、K+ | |
| C. | pH=0的溶液中:Na+、K+、Fe2+、NO3- | |
| D. | pH=7的溶液中:Al3+、Cl-、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
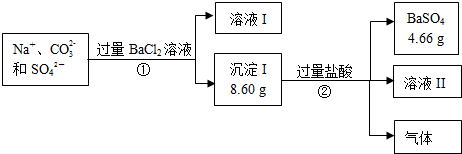
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com