
| A | 将磁性氧化铁溶于HI溶液:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| B | 明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
| C | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- |
| D | NH4HCO3溶液中滴入过量的NaOH溶液:HCO3-+OH-═CO32-+H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碘离子容易被铁离子氧化成碘单质;
B.硫酸根离子恰好沉淀时,铝离子与氢氧根离子的物质的量之比为1:4,二者反应生成偏铝酸根离子;
C.二氧化硫少量,反应生成碳酸氢钠和亚硫酸钠;
D.氢氧化钠过量,铵根离子和碳酸氢根离子都参与反应,漏掉了铵根离子与氢氧根离子的反应.
解答 解:A.铁离子能够氧化碘离子,正确的离子方程式为:2I-+Fe3O4+8H+=3Fe2++4H2O+I2,故A错误;
B.明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,硫酸铝钾与氢氧化钡的物质的量之比为1:2,反应生成偏铝酸钠,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故B错误;
C.用碳酸钠溶液吸收少量二氧化硫,反应生成亚硫酸钠和碳酸氢钠,反应的离子方程式为:2CO32-+SO2+H2O═2HCO3-+SO32-,故C正确;
D.碳酸氢铵与足量氢氧化钠反应生成碳酸钠、一水合氨和水,正确的离子方程式为:2OH-+NH4++HCO3-=CO32-+NH3•H2O+H2O,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Fe3+、Cl-、NO3- | B. | Na+、Ca2+、HCO3-、NO3- | ||
| C. | Al3+、NH4+、SO42-、Na+ | D. | Na+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将钢闸门与直流电源的正极相连,可降低钢闸门腐蚀速率 | |
| B. | 镀锌铁制品镀层受损后,铁制品仍不易生锈 | |
| C. | 粗铜精炼时,电镀液中的c(Cu2+)保持不变 | |
| D. | 纯银在空气中久置变黑发生的是电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若5.6LN2中含有n个氮分子,则阿伏加德罗常数一定为4n | |
| B. | 4.6gNa与100 mL含0.1mol HCl的盐酸溶液反应,转移电子数目为0.2NA | |
| C. | 14g乙烯和丙烯的混合气体中所含分子总数为0.5NA | |
| D. | 标准状况下,22.4LCCl4含有的分子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1=△H2 | B. | △H1>△H2 | C. | △H1<△H2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
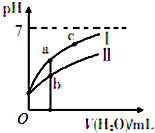 已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.
已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | K$_{{a}_{1}}$a1=4.4×10-7K$_{{a}_{2}}$a2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在周期表中过渡元素可作为催化剂 | |
| B. | 化学键可以使离子结合,也可以使原子结合 | |
| C. | 常温常压下,相同体积的O2和O3具有相同的分子数 | |
| D. | F2、Cl2、Br2、I2共价键逐渐增强,熔点依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
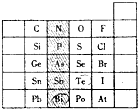 元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com