
| A、1.5mol/L |
| B、0.75mol/L |
| C、0.5mol/L |
| D、0.25mol/L |


科目:高中化学 来源: 题型:
| A、升高温度 |
| B、改用含有少量杂质铜的锌 |
| C、改用98%的浓硫酸 |
| D、加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
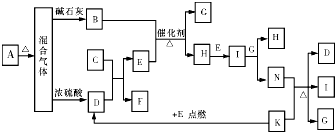 如图中的B~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是常见的气体单质,I是红棕色的气态氧化物.固态物质A(混合物)加热后生成的气体混合物若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D.各物质间的转化关系如图所示.请回答下列问题:
如图中的B~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是常见的气体单质,I是红棕色的气态氧化物.固态物质A(混合物)加热后生成的气体混合物若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D.各物质间的转化关系如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH) |
| B、0.2mol/L NH4NO3和0.1 mol/L NaOH溶液等体积混合后:c(NH4+)>c(NO3-)>c(Na+)>c(OH-)>c(H+) |
| C、常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大 |
| D、同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3?H2O ④CH3COONH4,其中c(NH4+)由大到小的顺序是:①>②>④>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
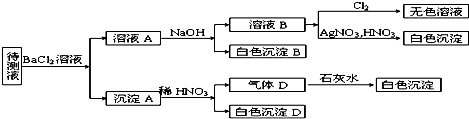
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入足量CO2后的溶液中:Na+、SiO32-、C6H5O-、CH3COO- | ||
B、
| ||
| C、pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | ||
| D、c(ClO-)=1.0 mol?L-1的溶液:Na+、SO32-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都呈透明的红褐色 |
| B、都比较稳定,密封保存一段时间都不会产生沉淀 |
| C、分散质颗粒直径相同 |
| D、当有光线透过时,都能产生丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com