
分析 根据n=$\frac{m}{M}$计算二氧化硫的物质的量,根据V=nVm计算其体积,由PV=nRT,可知体积之比等于其温度之比;氧原子物质的量为二氧化硫的2倍,根据ρ=$\frac{M}{{V}_{m}}$计算标况下密度.
解答 解:二氧化硫的物质的量为$\frac{19.2L}{64g/mol}$=0.3mol,标况下体积为0.3mol×22.4L/mol=6.72L,由PV=nRT,可知压强、物质的量相同条件下,气体的体积之比等于其温度(绝对温度)之比,在25℃、105Pa下体积为为6.72L×$\frac{273+25}{273}$=7.34L,含有氧原子物质的量为0.3mol×2=0.6mol,标况下的密度为$\frac{64g/mol}{22.4L/mol}$=2.86g/L,
故答案为:6.72;7.34;0.6;2.86g/L.
点评 本题考查物质的量有关计算、阿伏伽德罗定律及推论,注意根据PV=nRT理解阿伏伽德罗定律及推论,难度不大.


科目:高中化学 来源: 题型:解答题
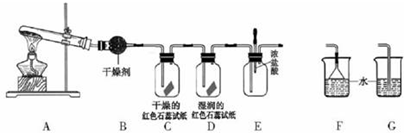
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | Y | |
| Z | W |
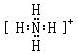 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
| 探究① | A.用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 | a.溶液pH=8 | i.S2O32-+H2O?HS2O3-+OH- |
| B.向pH=2的硫酸中滴加Na2S2O3溶液 | b.有淡黄色沉淀(或乳白色浑浊)和无色刺激性气味气体产生 | ii.S2O32一+2H+=S↓+SO2↑ +H2O | |
| 探究② | C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | c.氯水颜色变浅 | iii.S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3)(4) | B. | (1)(3)(5) | C. | (2)(4)(5) | D. | (1)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 阳极上产生能够使湿润淀粉碘化钾试纸变蓝的气体 | |
| B. | 电解一段时间后,电解池的温度升高10℃,此时铁片上析出气体的速率加快 | |
| C. | 电解时钠离子向铜片电极方向移动 | |
| D. | 电解一段时间后溶液中会出现蓝色沉淀,总反应为:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2↓+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁(26Fe)是地球上分布最广的金属之一,约占地壳质量的5.1%,居元素分布序列中的第四位,仅次于O、Si和Al.请结合所学知识回答下列问题:
铁(26Fe)是地球上分布最广的金属之一,约占地壳质量的5.1%,居元素分布序列中的第四位,仅次于O、Si和Al.请结合所学知识回答下列问题: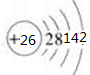
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
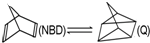 △H=+88.62kJ•mol-1,下列说法不正确的是( )
△H=+88.62kJ•mol-1,下列说法不正确的是( )| A. | 92gNBD经太阳照射后完全转化为Q时需吸收88.62kJ热量 | |
| B. | NBD可开发为贮能材料 | |
| C. | NBD、Q、甲苯三者互为同系物 | |
| D. | NBD、Q、甲苯三者是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
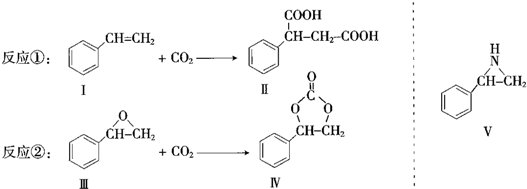
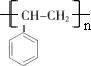 .
.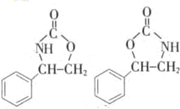 (任写一种).
(任写一种).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com