
| A. | 乙烷、乙醇和乙酸都可以与钠反应生成氢气 | |
| B. | 石油分馏可获得甲烷、乙烯、苯等 | |
| C. | 苯和乙烯都可以使溴的四氯化碳溶液褪色 | |
| D. |  已知上海世博会永久性标志建筑之-上海世博轴(如图)的上层巨型膜结构ETFE由单体乙烯和四氟乙烯加聚而成:其结构简式为: 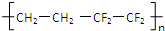 |
分析 A.含-OH、-COOH的有机物与Na反应,而乙烷不能与Na反应;
B.石油分馏为物理变化;
C.乙烯与溴发生加成反应,苯与溴的四氯化碳溶液不反应;
D.ETFE由单体乙烯和四氟乙烯加聚而成,主链中含4个C.
解答 解:A.含-OH、-COOH的有机物与Na反应,则乙醇和乙酸都可以与钠反应生成氢气,而乙烷不能与Na反应,故A错误;
B.石油分馏为物理变化,而石油裂解得到甲烷、乙烯,煤的干馏得到苯,故B错误;
C.乙烯与溴发生加成反应,苯与溴的四氯化碳溶液不反应,则乙烯可以使溴的四氯化碳溶液褪色,而苯不能,故C错误;
D.ETFE由单体乙烯和四氟乙烯加聚而成,主链中含4个C,结构简式为: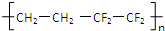 ,故D正确;
,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应等为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,原理相似 | |
| B. | 石油裂化的主要目的是为了提高轻质液体燃料的产量 | |
| C. | 2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| D. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取5.85g NaCl固体 | |
| B. | 将称出的固体在容量瓶中充分溶解 | |
| C. | 将烧杯紧靠容量瓶的瓶口转移溶液 | |
| D. | 当液面距离量瓶瓶颈的刻度线下1~2cm时,改用胶头滴管定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述生成Ni(CO)4的反应为放热反应 | |
| B. | 在80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol•L-1,则此时v正>v逆 | |
| C. | 25℃时反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为2×10-5 | |
| D. | 80℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、Fe3+、NO3-、I- | |
| B. | 水电离出的c(H+)=1×10-12mol•L-1的溶液中:K+、Al3+、Cl-、SO42- | |
| C. | c(AlO2-)=0.1 mol•L-1的溶液中:Na+、K+、HCO3-、Cl- | |
| D. | 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com