
【题目】若NA表示阿伏加德罗常数,下列说法中,正确的是( )
A.1 mol Cl2全部作为氧化剂时,失去的电子数为2NA个
B.在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C.25 ℃,1.01×105 Pa,64 g SO2中含有的原子数为3 NA个
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
科目:高中化学 来源: 题型:
【题目】模拟电渗析法将海水淡化的工作原理示意图如下。己知X、Y均为惰性电极,模拟海水中富含Na+、Cl—、Ca2+、Mg2+、SO42—等离子。下列叙述中不正确的是

A.N是阴离子交换膜
B.Y电极上产生有色气体
C.X电极区域有浑浊产生
D.X电极反应式为4OH——4e—=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
①H2(g)+I2(?)![]() 2HI(g) ΔH1=-9.48 kJ·mol-1
2HI(g) ΔH1=-9.48 kJ·mol-1
②H2(g)+I2(?)![]() 2HI(g) ΔH2=+26.48 kJ·mol-1
2HI(g) ΔH2=+26.48 kJ·mol-1
下列判断不正确的是( )
A.①中的I2为气态,②中的I2为固态
B.②的反应物总能量比①的反应物总能量低
C.反应①的产物比反应②的产物热稳定性更好
D.1 mol固态碘升华时将吸热35.96 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
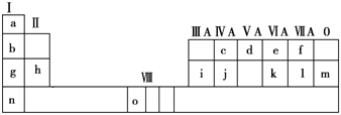
试回答下列问题:
(1)请写出元素o的基态原子电子排布式__________________________________。
(2)d的氢化物的分子构型为____________,中心原子的杂化形式为________;k在空气中燃烧产物的分子构型为________,中心原子的杂化形式为________,该分子是________(填“极性”或“非极性”)分子。
(3)第三周期8种元素按单质熔点高低的顺序排列如图,其中序号“8”代表________(填元素符号);其中电负性最大的是________(填图中的序号)。
(4)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是________,试从结构角度加以解释______________。
(5)i单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
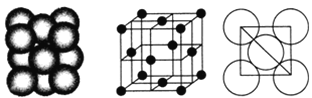
甲 乙 丙
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
②该晶体的密度为________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。

下列说法不正确的是
A.步骤a的操作包括过滤、洗涤和干燥
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H+ +O2↑
C.工业上将ClO2气体制成NaCIO2固体,其主要目的是便于贮存和运输
D.通入的空气的目的是驱赶出ClO2,使其被吸收其充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土元素包括钪、亿和系共17种元素,是重要的战略资源,我国稀土资源丰富。从氟碳铈矿(主要化学成分为CeFCO3)提取铈族稀土元素的一种工艺流程如图:
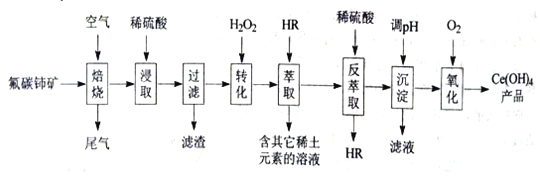
已知:①焙烧后铈元素主要以CeO2形式存在,Ce(
OH)3的Ksp=10×10-20
②Ce4+能与SO42-结合成[CeSO4]2+,Ce3+能被萃取剂HR萃取
(1)为提高原料的利用率,焙烧前应将矿石____处理。
(2)“浸取”过程中铈元素发生反应的离子方程式为___。
(3)“转化”过程中H2O2的作用是___。
(4)“萃取”过程中发生反应:Ce3+(水层)+3HR(有机层)CeR3(有机层)+3H+(水层)设计“萃取”和“反萃取”操作的目的是___;HR应该具有的特点是____。
a.萃取剂HR的密度一定比水大
b.萃取剂HR不溶于水,也不和水反应
c.萃取剂HR和Ce3+不反应
d.Ce3+在萃取剂中溶解度大于水中
(5)“调节pH”时,为了使Ce3+完全沉淀(浓度小于1×10-5mol/L),溶液的pH应大于___。
(6)“氧化”操作得到产品的化学方程式为____。
(7)CeO2是汽车尾气净化器中的关键催化剂,能在还原性气氛中供氧,在氧化性气氛中耗氧,过程为:2CeO22CeO2-x+xO2↑(0≤x≤0.5)。写出CeO2消除CO的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用多孔石墨电极完成下列实验,下列解释或推断不合理的是( )
实验 |
| ||
现象 | (i)中a、b两极均有气泡产生 | (ii)中b极上析出红色固体 | (iii)中b极上析出灰白色固体 |
A.(i)中,a电极上既发生了化学变化,也发生了物理变化
B.电解一段时间后,(i)中溶液浓度不一定会升高
C.(ii)中发生的反应为H2+Cu2+=2H++Cu↓
D.(iii)中发生的反应只可能是2Ag+Cu=2Ag++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
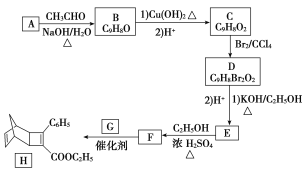
已知:①RCHO+CH3CHO![]() RCH===CHCHO+H2O;②||+
RCH===CHCHO+H2O;②||+![]()
![]() 。
。
回答下列问题:
(1)A的化学名称是________。
(2)由C生成D和E生成F的反应类型分别是________、________。
(3)E的结构简式为_________________________________。
(4)由B 生成C加入氢氧化铜,加热反应的化学方程式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是
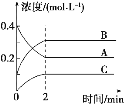
A. 发生的反应可表示为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
B. 前2 min A的分解速率为0.1 mol/(L·min)
C. 开始时,正、逆反应同时开始
D. 2 min时,A、B、C的浓度之比为2∶3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com