
| ||
| 0.5min |
| 10-3×10-3 |
| 0.1-10-3 |


科目:高中化学 来源: 题型:
| A、①② | B、③④ |
| C、①②③④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

| ||
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 结构简式 | 化学式 | 相对分子质量 | 沸点/℃ |
| (1)H-OH | H2O | 18 | 100 |
| (2)CH3-OH | CH4O | 32 | 64 |
| (3)CH3CH2OH | C2H6O | 46 | 78 |
| (4)CH3COOH | C2H4O2 | 60 | 118 |
| (5)CH3-O-CH3 | C2H6O | 58 | 56 |
| (6)CH3CH2CH2OH | C3H8O | 60 | 97 |
| (7)CH3CH2OCH3 | C3H8O | 60 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
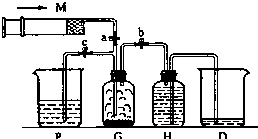 某课外活动小组利用下列装置迅速制备少量氯气.提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体.(2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)试回答:
某课外活动小组利用下列装置迅速制备少量氯气.提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体.(2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
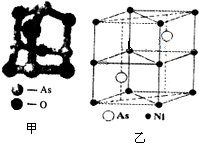 传统中药的砷剂俗称“砒霜”,请回答下列问题:
传统中药的砷剂俗称“砒霜”,请回答下列问题:| NH3 | PH3 | AsH3 | |
| 键角/° | 107.8 | 93.6 | 91.8 |
| 熔点/℃ | -77.74 | -134 | -117 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=2的溶液中:SO42-、K+、NO3-、Mg2+ |
| B、pH试纸呈现红色的溶液:Fe2+、K+、NO3-、Na+ |
| C、水电离出的c(H+)=10-12mol/L的溶液中:Na+、HCO3-、Cl-、SO42- |
| D、中性溶液中:Fe3+、Al3+、NO3-、I-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com