
 来总物质的量分数为
来总物质的量分数为  备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
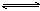 4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是
4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是| A.v(O2)=0.01mol/(L· s) | B.v(NO)=0.008mol/(L· s) |
| C.v(H2O)=0.015mol/(L· s) | D.v(NH3)=0.002mol/(L· s) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增加C的量 |
| B.将容器的体积缩小一半 |
| C.保持体积不变,充入N2,使体系的压强增大 |
| D.保持压强不变,充入N2,使容器的体积变大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在溶液中滴加少量硫酸铜溶液 | B.适当增大硫酸的浓度 |
| C.对反应溶液进行加热 | D.增大外界压强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g);⊿H<0。为了探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
CH3OH(g)+H2O(g);⊿H<0。为了探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com