

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。
ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。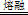 □Na2ZrO3+□CO2+□H2O
□Na2ZrO3+□CO2+□H2O
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(
、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾( )和明矾[Kal(SO4)2
)和明矾[Kal(SO4)2 12H2O]的操作流程如下:
12H2O]的操作流程如下:

 标准溶液进行滴定(MnO
标准溶液进行滴定(MnO 被还原为
被还原为 )。
)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.上述实验中,共涉及四个氧化还原反应 |
| B.实验可证明还原性:H+>Fe2+>OH->I- |
| C.实验②可证明溶解度:Fe(OH)3>Fe(OH)2 |
| D.实验③中,反应的离子方程式是:2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1molAl和足量的NaOH溶液反应,失去的电子数为3NA(NA表示阿伏加德罗常数) |
| B.原电池的负极发生氧化反应,电解池的阳极发生还原反应 |
| C.Cu能被FeCl3溶液腐蚀,其离子方程式为:Cu+Fe3+=Cu2++Fe2+ |
| D.Na+、Ba2+、NO3-、SO32-四种离子在溶液中因发生氧化还原反应而不能大量共存 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuS的溶解度大于PbS的溶解度 |
| B.原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| C.CuSO4与ZnS反应的离子方程式是Cu2++S2-====CuS↓ |
| D.整个过程涉及的反应类型有氧化还原反应和复分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com