
| ||
| 23g/mol |
| ||
| 27g/mol |
| 11.2L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、M和N可能都是固体 |
| B、若N为固体.则M一定是气体 |
| C、M和N一定都是气体 |
| D、若M为固体.则N一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.45mol?L-1?s-1 |
| B、v(B)=0.6mol?L-1?s-1 |
| C、v(C)=0.5mol?L-1?s-1 |
| D、v(D)=0.4mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、33.6升CO2与O2的混合气中,含有的氧原子数为3 NA |
| B、15克甲基正离子(CH3+)含有的电子数为8NA |
| C、1molCl2与任何物质充分作用,转移电子数都为2NA |
| D、将0.1 mol N2和0.3 mol H2置于密闭容中充分反应,可得0.2NA个NH3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
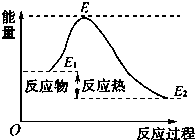
| A、反应物分子间的有效碰撞是反应的先决条件 |
| B、反应物的分子的每次碰撞都能发生化学反应 |
| C、活化分子具有比普通分子更高的能量 |
| D、如图所示正反应的活化能为E-E 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3的电离方程式:CaCO3?Ca2++CO32- |
| B、HCO3-的水解方程式:HCO3-+H2O?H3O++CO32- |
| C、CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
| D、BaSO4的沉淀溶解平衡表达式:BaSO4(s)?Ba2+(aq)+SO42-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:
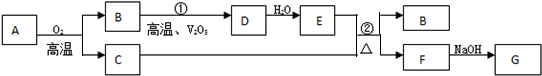
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com