
| 1 |
| 2 |
| 1 |
| 8 |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
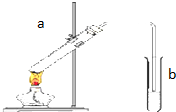 用如图所示的装置制取乙酸乙酯.回答下列问题:
用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
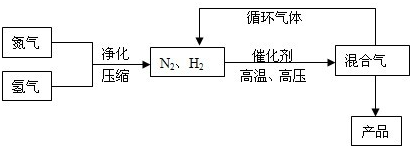
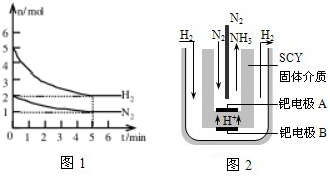
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
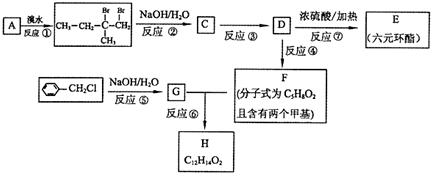
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方案甲 | 取该红色沉淀溶于稀硫酸中,观察是否有残渣. |
| 方案乙 | 取该红色沉淀溶于稀硝酸中,观察溶液颜色. |
| 方案丙 | 称取红色沉淀a g,在空气中充分灼烧至完全变成b g黑色的CuO,比较a和b的关系. |
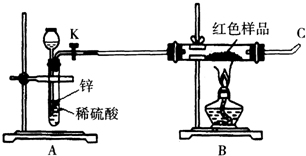
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com