
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+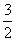 O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+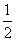 O2(g)===CO2(g) ΔH=-283.0 kJ·
O2(g)===CO2(g) ΔH=-283.0 kJ· mol-1
mol-1
H2(g)+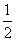 O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲 醇反应的反应速率的是________(填写序号).
醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
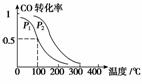
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大” 、“
、“ 减小”或“不变”)。
减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
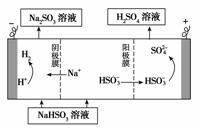
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式________________。
科目:高中化学 来源: 题型:
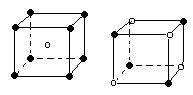
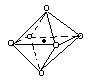
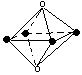
下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的图象是
 | |||||
 | |||||
 | |||||
⑴ ⑵ ⑶ ⑷
A.图⑴和图⑶ B.图⑵和图⑶ C.只有图⑴ D.图⑴和图⑷
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中信息判断,下列选项不正确的是
| 序号 | 反应物 | 产物 |
| ① | KMnO4 、H2O2 、H2SO4 | K2SO4 、MnSO4 ...... |
| ② | Cl2 、FeBr2 | FeCl3 、FeBr3 |
| ③ | MnO4- .... | Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比小于或等于1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ > Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
.T1℃时,向容积为2 L的密闭容器中 充入一定量的A气体和B气体,发生如下反应:
充入一定量的A气体和B气体,发生如下反应:
A(g)+2B(g) C(g)
C(g)
反应过程中测定的部分数据见下表:
| 反应时间/min | n(A)/mol | n(B)/ mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | 0.20 |
下列说法正确的是
A.前10 min内反应的平均速率为v(C)=0.050 mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)<0.25 mol
C.若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动
D.温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各反应对应的离子方程式正确的是( )
A.次氯酸钠溶液中通入过量二氧化硫ClO- + H2O + SO2 = HClO + HSO3-
B.向碳酸氢钠溶液中加入过量氢氧化钙溶液2HCO3-+ Ca2++2OH-= CaCO3↓+2H2O+CO32-
C.氢氧化钡溶液与硫酸溶液反应得到中性溶液Ba2++OH-+ H++SO42— = BaSO4↓+H2O
D.50 mL 1mol/L的NaOH溶液中通入0.03 mol H2S 5OH- + 3H2S = HS— + 2S2- + 5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
硅基太阳电池需 用化合物甲作钝化材料,甲的摩尔质量为140 g·mol-1,其中硅元素的质量分数为60%。已知1 molNH3与足量的化合物乙充分反应后可得到35 g 甲与6 g H2。工业上制乙的流程如下:
用化合物甲作钝化材料,甲的摩尔质量为140 g·mol-1,其中硅元素的质量分数为60%。已知1 molNH3与足量的化合物乙充分反应后可得到35 g 甲与6 g H2。工业上制乙的流程如下:
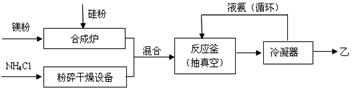
请回答下列问题:
(1)乙的电子式是 ;比较热稳定性:乙_______NH3(填>,<或=)。
(2)NH3与足量的化合物乙反应制甲的化学方程式是 。
(3)合成炉内物质需在保护气氛下高温合成,下列气体可作保护气的有 (填字母编号)。
A.O2 B.H2 C.N2 D.CO2 E.Ar
(4)上述生产乙的过程中液氨的作用是______________________________________。
(5)甲与少量H2SO4溶液反应只得到H2SiO3和盐M两种产物,写出该反应的离子方程式 。请设计验证产物盐M的实验方案 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有HCO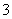 、CO
、CO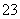 、SO
、SO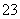 、Na+、NO
、Na+、NO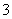 五种离子。若向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),
五种离子。若向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计), 溶液中离子浓度保持不变的是
溶液中离子浓度保持不变的是
A.NO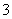 B.CO
B.CO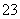 、NO
、NO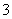
C.SO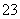 、NO
、NO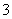 D.CO
D.CO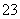 、NO
、NO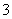 、Na+
、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g) 2c(g);ΔH1<0
2c(g);ΔH1<0
x(g)+3y(g) 2z(g);ΔH2>0
2z(g);ΔH2>0
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是( )
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com