
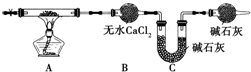
分析 (1)铜与空气中的氧气、二氧化碳和水等物质反应产生铜锈(铜绿),据此答题;
(2)B装置改为洗气瓶装置,依据气体冒出的现象判断是否反应完全;
(3)X1热分解的产物能使澄清石灰水变浑浊,而X2热分解的产物不能使澄清石灰水变浑浊,但两者均有水珠产生,说明都是碱式盐;B吸收水,C吸收二氧化碳;△m(B):△m(C)=9:11,X由两种物质X1和X2组成,且都由四种元素组成,实验结束后,硬质玻璃管内均残留黑色固体判断为CuO,结合原子守恒计算得到;
(4)先通过定性实验判断X1和X2的元素组成,加热分解均有水珠生成,说明都是碱式盐,X1受热分解产生CO2气体,说明X1中含有CO32-,因此X1的组成可表示为Cuz(OH)x(CO3)y,X2(由4种元素构成)受热分解无CO2气体生成,根据结构CuCuClCu2O-→X,可推测X2中含有的另一元素为Cl,X2的组成可表示为Cuz(OH)xCly.
解答 解:(1)铜与空气中的氧气、二氧化碳和水等物质反应产生铜锈(铜绿),所以要防止青铜器接触潮湿的空气,
故答案为:与H2O和O2隔绝;
(2)利用上述装置进行热分解实验时,对判断A装置中反应是否完全进行带来困难,为解决此问题,依据气体冒出的现象判断是否反应完全,要对B装置进行改装,换做盛有浓硫酸的洗气瓶,当瓶内到期滚无气泡冒出说明反应完全,最终得出的测定结果仍有误差的原因为:实验前装置内空气中的某些成分干扰了实验或反应结束后装置内的气体没有被B和C完全吸收;
故答案为:浓硫酸;洗气瓶中不再有气泡冒出;实验前装置内空气中的某些成分干扰了实验或反应结束后装置内的气体没有被B和C完全吸收;
(3)X1热分解的产物能使澄清石灰水变浑浊,而X2热分解的产物不能使澄清石灰水变浑浊,但两者均有水珠产生;B吸收水,C吸收二氧化碳;△m(B):△m(C)=9:11,物质的量之比为:n(H2O):n(CO2)=$\frac{9}{18}$:$\frac{11}{44}$=2;1,反应分解生成水和二氧化碳,硬质玻璃管内均残留黑色固体为CuO,由四种元素组成,则X1分解为CuO+2H2O+CO2结合原子守恒得到Cu2(OH)2CO3;
故答案为:能;Cu2(OH)2CO3 ;
(4)测得X2中铜元素的质量分数为59.5%(铜元素的相对原子质量为63.5),X2热分解的产物不能使澄清石灰水变浑浊,说明不含有碳元素,但有水珠产生说明含有氢元素和氧元素,X2的组成为Cuz(OH)xCly,铜元素的质量分数的表达式为$\frac{63.5z}{M}$×100%=Cu%=59.5%,又根据化合价代数和等于0可得63.5z+17x+35.5y,2z=x+y,解得x:y=3:1,故X2的化学式为Cu2(OH)3Cl.结合题中性质和现象不难写出热分解的化学方程式:Cu2(OH)3Cl,Cu2(OH)3Cl=2CuO+H2O↑+HCl↑.
故答案为:Cu2(OH)3Cl,Cu2(OH)3Cl=2CuO+H2O↑+HCl↑.
点评 本题考查了物质组成的分析,物质性质的反应产物判断方法,实验过程的理解应用,化学式的计算分析,掌握基础是关键,题目难度较大.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ③④⑤⑥⑦ | C. | ③⑥⑦ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C12 | B. | NH3 | C. | BaCO3 | D. | C2H5OH (乙醇) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L0.1mol/L的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 在含4mol Si-O键的二氧化硅中,氧原子数为4NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com