
| y |
| 2 |


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:
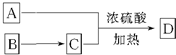 所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式
所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
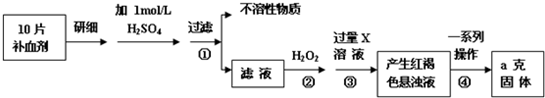
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| ① |
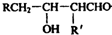
| △ |
| ② |

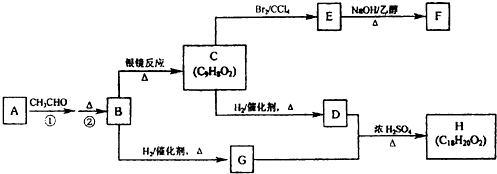
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学在探究常见物质转化时,发现部分物质间可存在如图所示的三角转换关系.已知:
某同学在探究常见物质转化时,发现部分物质间可存在如图所示的三角转换关系.已知:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、曲线a表示氯离子 |
| B、曲线b表示碳酸根离子 |
| C、曲线c表示钠离子 |
| D、曲线d表示碳酸氢根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 |
| n(SO3)/mol | 1.6 | a |
| 反应物的转化率 | α1 | α2 |
| A、α1+α2>1 |
| B、1.6<a<3.2 |
| C、若甲中反应2 min时达到平衡,则2 min 内平均速率ν(O2)=0.2 mol?L-1?min-1 |
| D、甲平衡后再加入0.2molSO2、0.2molO2和0.4 molSO3,平衡正向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com