
| n |
| V |
| 消耗量 |
| 起始量 |
| 1.5mol |
| 5L |
| 1.5mol |
| 4mol |
(
| ||||
(
|


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
| A、28种 | B、32种 |
| C、40种 | D、48种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
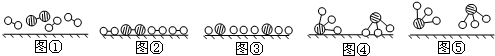
 、
、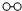 、
、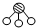 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.6mol/L |
| B、3.2mol/L |
| C、2.5mol/L |
| D、1.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、电解转移3mol e-时,理论上可制得KIO3 107 g |
| B、电解时,石墨作阳极,不锈钢作阴极 |
| C、电解时的阳极电极反应式:I--6e-+3H2O═IO3-+6H+ |
| D、电解过程中电解质溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl |
| B、A1C13 |
| C、KCl |
| D、CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在1 L 0.2mol?L-1的Na2CO3溶液中含有CO32-的数目为0.2NA |
| B、0.1 mol Na参加氧化还原反应,Na转移的电子数目一定是0.1NA |
| C、电解精炼铜时,若阴极得到的电子数为2NA,则阳极质量减少64克 |
| D、18.0g重水(D2O)所含的电子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com