
| A. | 200mL 2mol/L MgCl2溶液 | B. | 1000mL 2.5mol/L NaCl溶液 | ||
| C. | 250mL 1mol/L AlCl3溶液 | D. | 300mL 5mol/L KCl溶液 |
分析 根据溶液中C(Cl-)=溶质的物质的量浓度×化学式中氯离子个数,与溶液的体积无关,结合选项判断即可.
解答 解:A、200mL2mol/L KCl溶液中c(Cl-)=c(KCl)=2mol/L×1=2mol/L;
B、1000mL2.5mol/L NaCl溶液中c(Cl-)=c(NaCl)=2.5mol/L;
C、250mL1 mol/L AlCl3溶液中c(Cl-)=3c(AlCl3)=1mol/L×3=3mol/L;
D、300mL5mol/L KCl溶液中c(Cl-)=c( KCl)=5mol/L×1=5mol/L;
所以氯离子浓度最大的是5mol/L;
故选D.
点评 本题考查了物质的量浓度的有关计算,根据溶液中c(Cl-)=溶质的物质的量浓度×化学式中氯离子个数来解答即可,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 冰融化为水的过程△H>0,△S<0 | |
| B. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 | |
| C. | 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 | |
| D. | NH4HCO3(s)?NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
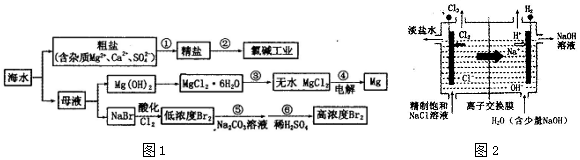
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打可以与胃酸反应,可用小苏打治疗胃酸过多 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果发生了加成反应 | |
| C. | 食品脱氧剂(含铁粉、氯化钠、炭粉等)的脱氧原理与钢铁的吸氧腐蚀相同 | |
| D. | 加人足量氢氧化钠溶液共热.能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 没有阳光 | B. | 温度太低 | C. | 压强太大 | D. | 缺少CO2和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+ )>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1 mol/L pH为3的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH- )=c(H+) | |
| D. | c(NH4+ )相等的(NH4)2SO4溶液、(NH4)2Fe (SO4)2溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2Fe (SO4)2]<c(NH4Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{4c-b-2a}{2}$ kJ | B. | $\frac{4c+b-2a}{2}$ kJ | C. | (4c+b-2a) kJ | D. | (4c-b+2a) kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需用四个不同的量子数来描述原子中的每一个电子 | |
| B. | 在原子中,不能有两个电子具有一组相同的量子数 | |
| C. | 充满一个电子层需要8个电子 | |
| D. | 电子之间存在着斥力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com