
| A、碳酸氢钠溶液与过量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| B、向溴化亚铁溶液中通入过量氯气:Fe2++2Br-+2Cl2=Fe3++Br2+4Cl- |
| C、1 mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
| D、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
 硫的氧化物、氮的氧化物和一氧化碳是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
硫的氧化物、氮的氧化物和一氧化碳是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
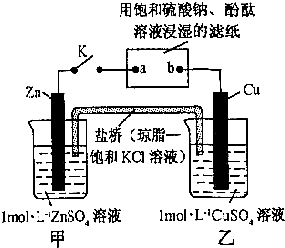
| A、Cu电极上发生还原反应 |
| B、电子沿Zn→a→b→Cu路径流动 |
| C、片刻后盐桥中Cl-向左移动 |
| D、片刻后可观察到滤纸a点变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在足量硝酸中,〔Cu(NH3)4〕2+、Cl-、Na+、Br- | ||
| B、能使碘化钾淀粉试纸变蓝的溶液中,K+、Fe2+、SO42-、Cl- | ||
C、常温下,c(H+)=
| ||
| D、c(OH-)/c(H+)=1×10-12的溶液,NH4+、Mg2+、Cl-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaOCl2 |
| B、(NH4)2Fe(SO4)2 |
| C、BiONO3 |
| D、K3[Fe(CN)6] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、从原料消耗的角度来看,a路线制氢更有价值 |
| B、从能量消耗的角度来看,b路线制氢更加有利 |
| C、a路线制氢由于要消耗很多能量,所以在实际生产中意义不大 |
| D、降低温度,可提高b路线中乙醇的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、24 | B、40 | C、56 | D、65 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度 (mol/L) |
NaOH物质的量浓度 (mol/L) |
混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com